题目内容
下列有关实验操作的叙述正确的是
| A.配制FeCl3溶液时,将FeCl3溶解在较浓的盐酸中,再用水稀释到所需浓度 |
| B.进行焰色反应时,所用铂丝先用NaOH溶液洗涤并充分灼烧 |
| C.用CCl4萃取碘水中的I2时,有机层从分液漏斗的上端倒出 |
| D.酸碱中和滴定时,锥形瓶需用待测液润洗2次,再加入待测液 |
A
解析试题分析:氯化铁是能够水解的强酸弱碱盐,即FeCl3+3H2O Fe(OH)3+3HCl,用水溶解或稀释能促进铁离子水解,用盐酸溶解能抑制铁离子水解,故A选项正确;氢氧化钠溶液含有钠元素,引入钠元素导致火焰呈黄色,对实验结果造成干扰,因此不能用氢氧化钠溶液洗涤,应选稀盐酸洗涤铂丝,故B选项错误;四氯化碳的密度大于水,萃取之后有机层位于分液漏斗的下层,因此有机层先从分液漏斗的下端放出,然后水层从分液漏斗的上端倒出,故C选项错误;锥形瓶只需要用蒸馏水洗涤,如果用待测液润洗,则滴定时消耗标准溶液的体积偏大,导致测定结果偏高,只有酸式或碱式滴定管才能用待装液润洗,故D选项错误。
Fe(OH)3+3HCl,用水溶解或稀释能促进铁离子水解,用盐酸溶解能抑制铁离子水解,故A选项正确;氢氧化钠溶液含有钠元素,引入钠元素导致火焰呈黄色,对实验结果造成干扰,因此不能用氢氧化钠溶液洗涤,应选稀盐酸洗涤铂丝,故B选项错误;四氯化碳的密度大于水,萃取之后有机层位于分液漏斗的下层,因此有机层先从分液漏斗的下端放出,然后水层从分液漏斗的上端倒出,故C选项错误;锥形瓶只需要用蒸馏水洗涤,如果用待测液润洗,则滴定时消耗标准溶液的体积偏大,导致测定结果偏高,只有酸式或碱式滴定管才能用待装液润洗,故D选项错误。
考点:考查化学实验基本操作,涉及配制能水解的盐溶液的方法、焰色反应、钠元素的焰色反应、萃取、四氯化碳与水的密度关系、酸碱中和滴定、锥形瓶的使用方法等。

 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案下述实验方案能达到实验目的的是
| 编号 | A | B | C | D |
| 实验 方案 |  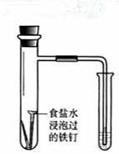 食盐水 |  片刻后在Fe电极附近滴入K3[Fe(CN)6]溶液 | 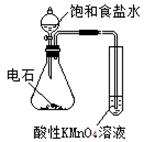 | 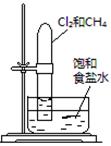 置于光亮处 |
| 实验 目的 | 验证铁钉发生 析氢腐蚀 | 验证Fe电极被保护 | 验证乙炔的还原性 | 验证甲烷与氯气发生 化学反应 |
下列实验操作及现象能够达到对应实验目的的是
| | 实验内容 | 实验目的 |
| A | 将SO2通入品红溶液中,品红褪色;加热褪色后品红溶液,溶液恢复红色 | 证明亚硫酸的不稳定性 |
| B | 常温下,向饱和Na2CO3溶液中加少量BaSO4粉末,过滤,向洗净的沉淀中加稀盐酸,有少量气泡产生 | 证明常温下KSP(BaSO4)>KSP(BaCO3) |
| C | 常温下测定物质的量浓度相同的盐酸和醋酸溶液的pH:盐酸pH小于醋酸pH | 证明相同条件下,在水中HCl电离程度大于CH3COOH |
| D | 将浓硫酸和碳混合加热,直接将生成的气体通入足量的澄清石灰水,石灰水变浑浊 | 检验气体产物中CO2的存在 |
下列实验装置是探究铜丝与过量浓硫酸的反应,下列叙述正确的是 ( )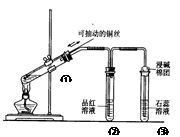
| A.上下移动①中铜丝可控制SO2的量 |
| B.②中品红溶液不褪色 |
| C.③中石蕊溶液变蓝色 |
| D.为确认CuSO4生成,向①中加水,观察溶液颜色 |
三氯异氰尿酸(结构简式如图)是一种极强的氧化剂和氯化剂。
(1)利用三氯异氰尿酸水解产物中的氧化性物质X可消毒灭菌,X的分子式为 。
(2)“有效氯”含量指从KI中氧化出相同量的I2所需Cl2的质量与指定化合物的质量之比,常以百分数表示。为测定三氯异氰尿酸的“有效氯”含量,现称取某三氯异氰尿酸样品0.5680 g,加水、足量KI、硫酸,配制成100 mL待测液;准确量取25.00 mL待测液于碘量瓶中,用0.1500 mol·L-1 Na2S2O3标准溶液滴定至溶液呈微黄色时,加入淀粉指示剂,继续滴定至终点(发生反应的方程式为:2Na2S2O3+I2=Na2S4O6+2NaI);重复测定2次,所得的相关数据如下表:
| 滴定序号 | 待测液体积/mL | 标准液滴定管起点读数/mL | 标准液滴定管终点读数/mL |
| 1 | 25.00 | 0.06 | 24.04 |
| 2 | 25.00 | 0.02 | 24.02 |
| 3 | 25.00 | 0.12 | 24.14 |
①滴定终点观察到的现象为 ;
②配制0.1500 mol·L-1 Na2S2O3溶液100 mL,所需Na2S2O3·5H2O的质量为 ;
③计算此样品的“有效氯”含量(写出计算过程)。
用下图所示装置进行实验,下表中实验结果能说明结论的是( )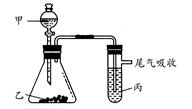
| | 甲 | 乙 | 丙 | 结论 |
| A | 水 | 电石 | 溴水 | 稳定性:水>C2H2>Br2 |
| B | 盐酸 | 石灰石 | 苯酚钠溶液 | 酸性:HCl>H2CO3>苯酚 |
| C | 盐酸 | FeS | 溴水 | 还原性:S2->Br->Cl- |
| D | 浓盐酸 | KMnO4 | KBr溶液 | 氧化性:KMnO4<Cl2<Br2 |

 A.定容
A.定容

 I2+5SO42—+H2O
I2+5SO42—+H2O