题目内容
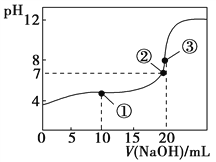
【题目】40℃时,在氨-水体系中不断通入CO2,各种离子的变化趋势如下图所示。下列说法不正确的是( )
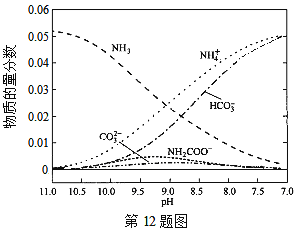
A.在pH=9.0时,c(NH4+)>c(HCO)>c(NH2COOˉ)>c(CO32-)
B.不同pH的溶液中存在关系:c(NH4+)+c(H+)=2c(CO32-)+c(HCO3-)+c(NH2COOˉ)+c(OHˉ)
C.随着CO2的通入,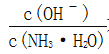 不断增大
不断增大
D.在溶液中pH不断降低的过程中,有含NH2COOˉ的中间产物生成
【答案】C
【解析】
A.pH=9时,图象中各种离子浓度的大小关系:c(NH4+)>c(HCO3-)>c(NH2COO-)>c(CO32-),故A正确;
B.溶液中存在电荷守恒,即正电荷的总浓度等于负电荷的总浓度,则不同pH的溶液中存在电荷守恒关系为:c(NH4+)+c(H+)=2c(CO32-)+c(HCO3-)+c(NH2COO-)+c(OH-),故B正确;
C.已知Kb=![]() ,温度一定时,Kb为常数,不随浓度的变化而变化,随着CO2的通入,c(NH4+)逐渐增大,则
,温度一定时,Kb为常数,不随浓度的变化而变化,随着CO2的通入,c(NH4+)逐渐增大,则![]() 不断减小,故C错误;
不断减小,故C错误;
D.由图象可知开始没有NH2COO-,后来也不存在NH2COO-,所以NH2COO-为中间产物,即在溶液pH不断降低的过程中,有含NH2COO-的中间产物生成,故D正确;
故选C。
【点晴】
本题考查了溶液中离子浓度大小比较、电荷守恒的应用、图象的分析与应用等,题目难度中等,侧重于考查学生对图象的分析与应用能力。判断溶液中的离子浓度的大小关系,需要理解电解质溶液中的守恒关系:电荷守恒:电解质溶液中所有阳离子所带有的正电荷数与所有的阴离子所带的负电荷数相等。如NaHCO3溶液中:n(Na+)+n(H+)=n(HCO3-)+2n(CO32-)+n(OH-)推出:c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-),物料守恒:电解质溶液中由于电离或水解因素,离子会发生变化变成其它离子或分子等,但离子或分子中某种特定元素的原子的总数是不会改变的。如NaHCO3溶液中:n(Na+):n(c)=1:1,推出:c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3);质子守恒:(不一定掌握)电解质溶液中分子或离子得到或失去质子(H+)的物质的量应相等。例如:在NH4HCO3溶液中H3O+、H2CO3为得到质子后的产物;NH3、OH-、CO32-为失去质子后的产物,故有以下关系:c(H3O+)+c(H2CO3)=c(NH3)+c(OH-)+c(CO32-)。

【题目】化学反应伴随能量变化,获取反应能量变化有多条途径。
(1)下列反应中,属于吸热反应的是________(填字母)。
A.Na与水反应 B.甲烷的燃烧反应 C.CaCO3受热分解 D.锌与盐酸反应
(2)获取能量变化的途径
①通过化学键的键能计算。已知:
化学键种类 | H—H | O=O | O—H |
键能(kJ/mol) | a | b | c |
计算可得:2H2(g)+ O2(g) =2H2O(g) H=_________kJ·mol-1(用a、b、c表示)
②通过物质所含能量计算。已知反应中A+B= C+D中A、B、C、D所含能量依次可表示为EA、EB、EC、ED,该反应H=_________。
(3)已知:4g CH4完全燃烧生成CO2(g)、H2O(l)时放出热量222.5 kJ,则表示甲烷燃烧的热化学方程式为________。
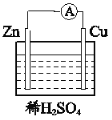
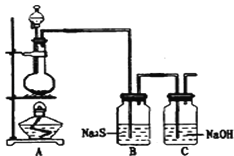
(4)下图所示装置可以说明有化学能转化为电能的实验现象为__________。