题目内容
【题目】在一个容积为2L的密闭容器中,加入0.8mol的A2气体和0.6molB2气体,一定条件下发生如下反应:A2(g)+B2(g)![]() 2AB(g) △H<0,反应中各物质的浓度随时间的变化情况如图所示。
2AB(g) △H<0,反应中各物质的浓度随时间的变化情况如图所示。

(1)在上述反应达到平衡后,第4min时,若将容器的体积快速扩大一倍(其他条件不变),请在图中画出4min~5min的AB浓度的变化线__________。
(2)在相同条件下,若开始时向此容器中加入的A2(g)、B2(g)和AB(g)的物质的量分别为0.7mol、0.5mol、0.2mol。则反应向_________反应方向进行(填“正”或“逆”)。判断依据是_______。反应达到平衡后,各物质的体积分数与原平衡相比_______(填序号)。
①A2、B2减小,AB增大 ②A2、B2增大,AB减小 ③均不变 ④无法确定
【答案】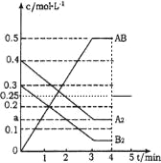 正 Qc<K ③
正 Qc<K ③
【解析】
(1)第4min时,若把容器的体积快速扩大一倍,瞬间AB的浓度变为原来的一半,该反应前后气体体积不变,压强只改变反应速率,不改变平衡移动,据此作图;
(2)根据图像可知,分析判断平衡时各物质的浓度计算平衡常数K,再计算判断浓度商Qc与 K的大小关系,判断反应的方向;若开始时向此容器中加入的A2(g)、B2(g)和AB(g)的物质的量分别为0.7mol、0.5mol、0.2mol,等效为开始加入0.8mol的A2气体和0.6molB2气体,与原平衡为完全等效平衡,平衡时相同组分的物质的量浓度相等,据此分析解答。
(1)上述反应达到平衡后,第4min时,若把容器的体积快速扩大一倍,瞬间AB的浓度变为原来的一半,该反应前后气体体积不变,压强只改变反应速率,不改变平衡移动,4min~5min的AB浓度的变化线为: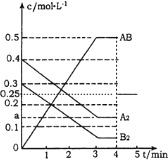 ,故答案为:
,故答案为: ;
;
(2)根据图可知,平衡时AB的浓度变化为0.5mol/L,则A2的浓度变化为0.25mol/L,所以a=0.4mol/L-0.25mol/L=0.15mol/L,平衡时B2的浓度为0.3mol/L-0.25mol/L=0.05mol/L,平衡常数K=![]() =
=![]() =
=![]() ,若开始时向此容器中加入的A2(g)、B2(g)和AB(g)的物质的量分别为0.7mol、0.5mol、0.2mol,浓度商Qc=
,若开始时向此容器中加入的A2(g)、B2(g)和AB(g)的物质的量分别为0.7mol、0.5mol、0.2mol,浓度商Qc=![]() =
=![]() <K=
<K=![]() ,反应向正反应进行,若开始时向此容器中加入的A2(g)、B2(g)和AB(g)的物质的量分别为0.7mol、0.5mol、0.2mol,等效为开始加入0.8mol的A2气体和0.6molB2气体,恒温恒容下,与原平衡为完全等效平衡,平衡时相同组分的物质的量浓度相等,反应达到平衡后,各物质的体积分数与原平衡相比均不变,故答案为:正;浓度商Qc<K;③。
,反应向正反应进行,若开始时向此容器中加入的A2(g)、B2(g)和AB(g)的物质的量分别为0.7mol、0.5mol、0.2mol,等效为开始加入0.8mol的A2气体和0.6molB2气体,恒温恒容下,与原平衡为完全等效平衡,平衡时相同组分的物质的量浓度相等,反应达到平衡后,各物质的体积分数与原平衡相比均不变,故答案为:正;浓度商Qc<K;③。





