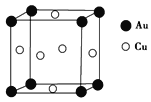
��Ŀ����
����Ŀ��������������Ԫ��A��B��C��D��Eԭ������������������A��B��Cԭ�Ӻ�����Ӳ���֮����5����Cԭ��������ϵĵ�����ΪA��B��Ԫ��ԭ��������Ӳ��ϵ��������ܺͣ�Cԭ�ӵļ۵��ӹ���Ϊnsnnpn+1��Aԭ�ӵ�������������������Ӳ�����D��E�����γ�ԭ�Ӹ�����Ϊ1��1��1��2���������ӻ������Dԭ�ӵ�2p�ܼ���������δ�ɶԵ��ӣ��Իش��������⣺
(1)B��C��D��E����Ԫ�ص�ԭ�ӣ��뾶�Ӵ�С��˳����__(��Ԫ�ط��Ż�ѧʽ����ͬ)����һ�����ܴӴ�С��˳����__
(2)Cԭ�ӵĵ����Ų�ͼ__��D2���Ľṹʾ��ͼ__��A��D���γɶ��ֻ��������һ��������������ˮ��Һ�������ԣ�д���û�����Ľṹʽ__�������к���__��(���������������Ǽ���������ͬ)��__���ӣ�
(3)A��B��D����Ԫ�ؿ����γɶ����л���������ӣ��������ԭ�������ٵ�һ��������װ��ʱ�γɵ���Ҫ������Ⱦ���д�����ĵ���ʽ__�����ݼ۲���ӶԻ���(VSEPR)�����Ʋ�÷�������ԭ�ӵ��ӻ���ʽΪ__�ӻ����ռ乹��Ϊ__��
(4)C��E�γ�һ�����ӻ�����Y����Ħ������Ϊ65g/mol��Y���Ȼ�ײ��ʱ�����ֽ�Ϊ���ֵ��ʣ���Y�Ļ�ѧʽΪ__��Y����������һ����������ӣ�ȫ��CԪ����ɣ�Y�����ᷴӦ�����ӷ���ʽΪ__��
���𰸡�)Na��C��N��O N��O��C��Na ![]()
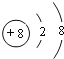 H��O��O��H ���ԡ��Ǽ��� ����
H��O��O��H ���ԡ��Ǽ��� ���� ![]() sp2 ƽ�������� NaN3 N3��+3H+=NH3��
sp2 ƽ�������� NaN3 N3��+3H+=NH3��
��������
������������Ԫ��A��B��C��D��Eԭ������������������A��B��Cԭ�Ӻ�����Ӳ���֮����5����A���ڵ�һ���ڣ�B��C���ڵڶ����ڣ�Aԭ�ӵ�������������������Ӳ�������AΪ��Ԫ�أ�Cԭ�ӵļ۵��ӹ���Ϊnsnnpn+1��s�ܼ�ֻ������2�����ӣ���n=2��Cԭ�ӵļ۵��ӹ���Ϊ2s22p3����CΪ��Ԫ�أ�Cԭ��������ϵĵ�����ΪA��B��Ԫ��ԭ��������Ӳ��ϵ��������ܺͣ���Bԭ������������Ϊ5-1=4����BΪ̼Ԫ�أ�Dԭ�ӵ�2p�ܼ���������δ�ɶԵ��ӣ�ԭ���������ڵ�Ԫ�أ���Dԭ�ӵļ۵��ӹ���Ϊ2s22p4����DΪ��Ԫ�أ�D��E�����γ�ԭ�Ӹ�����Ϊ1��1��1��2���������ӻ������EΪNaԪ�أ��ݴ˽����
��1��ͬ�����������ԭ�Ӱ뾶��С��ͬ�������϶���ԭ�Ӱ뾶����ԭ�Ӱ뾶Na��C��N��O��������ҵ�һ�����ܳ��������ƣ���Ԫ��ԭ��2p�ܼ�����3�����ӣ����ڰ����ȶ�״̬���������ͣ���һ�����ܸ���ͬ��������Ԫ�أ��ʵ�һ�����ܴӴ�С��˳����N��O��C��Na���ʴ�Ϊ��Na��C��N��O��N��O��C��Na��
��2��CΪ��Ԫ�أ�Nԭ�ӵĵ����Ų�ͼΪ![]() ��O2-�Ľṹʾ��ͼΪ
��O2-�Ľṹʾ��ͼΪ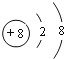 ��H��O���γɶ��ֻ��������һ��������������ˮ��Һ�������ԣ��û�����ΪH2O2���û�����ĽṹʽH-O-O-H����������ԭ������ԭ��֮��Ϊ���Լ�����ԭ��֮��Ϊ�Ǽ��Լ���Ϊչ����ҳ�ͽṹ���Ǽ��Է��ӣ�
��H��O���γɶ��ֻ��������һ��������������ˮ��Һ�������ԣ��û�����ΪH2O2���û�����ĽṹʽH-O-O-H����������ԭ������ԭ��֮��Ϊ���Լ�����ԭ��֮��Ϊ�Ǽ��Լ���Ϊչ����ҳ�ͽṹ���Ǽ��Է��ӣ�
�ʴ�Ϊ��![]() ��
��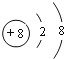 ��H-O-O-H�����ԡ��Ǽ��ԣ�������
��H-O-O-H�����ԡ��Ǽ��ԣ�������
��3��H��C��O����Ԫ�ؿ����γɶ����л���������ӣ��������ԭ�������ٵ�һ��������װ��ʱ�γɵ���Ҫ������Ⱦ��ΪHCHO�������ʽΪ![]() �����ݼ۲���ӶԻ��⣨VSEPR�����ۣ��÷�������ԭ��Cԭ�Ӽ۲���Ӷ�ˮΪ3�������µ��Ӷԣ���Cԭ�ӵ��ӻ���ʽΪsp2�ӻ����ռ乹��Ϊƽ�������Σ��ʴ�Ϊ��
�����ݼ۲���ӶԻ��⣨VSEPR�����ۣ��÷�������ԭ��Cԭ�Ӽ۲���Ӷ�ˮΪ3�������µ��Ӷԣ���Cԭ�ӵ��ӻ���ʽΪsp2�ӻ����ռ乹��Ϊƽ�������Σ��ʴ�Ϊ��![]() ��sp2��ƽ����������
��sp2��ƽ����������
��4��Na��N�γ�һ�����ӻ�����Y����Ħ������Ϊ65g/mol��Y���Ȼ�ײ��ʱ�����ֽ�Ϊ���ֵ��ʣ��ֽ�ΪNa�뵪����Y����������һ����������ӣ�ȫ��CԪ����ɣ������ΪNaxNy����23x+14y=65����x=1��y=3������YΪNaN3�������ᷴӦ�����ӷ���ʽΪN3-+3H+=NH3�����ʴ�Ϊ��NaN3��N3-+3H+=NH3����

����Ŀ��ijѧ��̽������ʵ��(A)��
ʵ��A | ���� | ���� |
| ���� | i�����Ⱥ���ɫ��ȥ ii����ȴ�����У���Һ�ָ���ɫ ��.һ��ʱ�����ɫ������ȥ |
��1��ʹ���۱�����������____��
��2����������i��ii��Ϊ�������������£����ȴٽ�����ˮ�⣬��ȴ��ƽ�������ƶ���
���ʵ�����£�������a��֤ʵ�÷�����������

������a����____��
��3���ٴη��������Ⱥ��ʵⷢ���˱仯��ʵ�����£�
I��ȡ������ˮ����������ɫ���õ�����Һ����ӷ��������ʣ�������
������ɫ�����Һ�еμӵ�����Һ����ȴ������һֱδ����������ϡH2SO4��˲�������
�Բ������ϡH2SO4�����ã�������ӷ���ʽ�����һ�ֺ����Ľ��ͣ�______________��
��4��̽����ˮ��ɫ����Һ�ijɷ֣�
ʵ��1�������Һ��pH��5
ʵ��2��ȡ��ɫ�����Һ���������ʵ�飺

�ٲ�����ɫ���������ӷ���ʽ��____��
��Ag2O��������____________��
����������ʵ�飬�Ʋ���Һ�к��е����ʣ������ӣ�������_________��
��5����ϻ�ѧ��Ӧ���ʽ���ʵ��A������i������iii��ɫ��ȥ��ԭ��_______________��