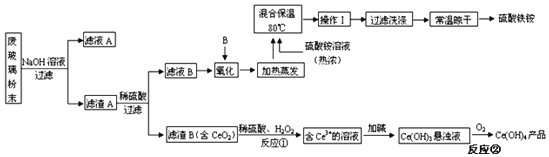
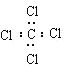题目内容
【题目】Ⅰ.由三种常见元素组成的化合物A,按如下流程进行实验。气体B、C、D均无色、无臭,B、D是纯净物;浓硫酸增重3.60g,碱石灰增重17.60g;溶液F焰色反应呈黄色。
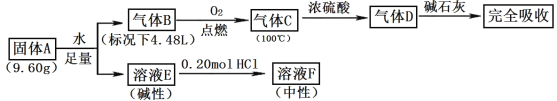
请回答:
(1)组成A的非金属元素是_____,气体B的结构简式_____。
(2)固体A与足量水反应的化学方程式是_____。
(3)一定条件下,气体D可能和FeO发生氧化还原反应,试写出一个可能的化学方程式_____。
Ⅱ.某兴趣小组为验证卤素单质的氧化性强弱,向NaBr溶液中通入一定量Cl2,将少量分液漏斗中溶液滴入试管中,取试管振荡,静止后观察现象。实验装置如图:
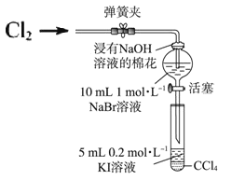
(4)说明氧化性 Br2>I2 的实验现象是_____。
(5)为了排除Cl2对溴置换碘实验的干扰,需确认分液漏斗中通入Cl2 未过量。试设计简单实验方案检____。
【答案】碳(C)和氢(H) CH≡CH NaHC2+H2O=NaOH+C2H2 CO2+2FeO![]() Fe2O3+CO 试管内溶液分层,且下层为紫红色,上层无色, 取分液漏斗中上层少量溶液于试管中,向试管中通入Cl2,若试管中溶液出现红棕色,说明有溴单质生成,可确定氯气未过量
Fe2O3+CO 试管内溶液分层,且下层为紫红色,上层无色, 取分液漏斗中上层少量溶液于试管中,向试管中通入Cl2,若试管中溶液出现红棕色,说明有溴单质生成,可确定氯气未过量
【解析】
Ⅰ.气体B在氧气中燃烧生成气体C,100℃时,气体C通过浓硫酸,浓硫酸增重 3.60g,增重的质量为H2O的质量,气体 B、C、D 均无色、无臭,B、D 是纯净物;气体D能被碱石灰吸收,则D为CO2,碱石灰增重 17.60g,即CO2的质量为17.60g,根据以上分析可得B和氧气反应生成CO2和H2O,B由C、H两种元素组成,CO2的物质的量为![]() =0.4mol,则碳元素的物质的量为0.4mol,H2O的物质的量为
=0.4mol,则碳元素的物质的量为0.4mol,H2O的物质的量为![]() =0.2mol,则氢元素的物质的量为0.4mol,气体B标况下的体积为4.48L,则B的物质的量为
=0.2mol,则氢元素的物质的量为0.4mol,气体B标况下的体积为4.48L,则B的物质的量为![]() =0.2mol,由碳、氢元素的物质的量与B的物质的量关系,可得B的化学式为C2H2,溶液 F 焰色反应呈黄色,则F中含有Na元素,根据反应流程,A、E中均含有Na元素,碱性溶液E与0.2molHCl恰好完全反应生成中性的F溶液,则F为NaCl,则n(Na)= n(Cl)= n(HCl)=0.2mol,由三种常见元素组成的化合物 A,与足量的水反应生成B和E,A中应含有C和Na元素,A的质量为9.6g,则第三种元素的质量为9.6g-0.4mol×12g/mol-0.2mol×23g/mol=0.2g,则A为C、H、Na三种元素组成,物质的量分别为0.4mol、0.2mol、0.2mol,则A的化学式为NaHC2,据此分析解答;
=0.2mol,由碳、氢元素的物质的量与B的物质的量关系,可得B的化学式为C2H2,溶液 F 焰色反应呈黄色,则F中含有Na元素,根据反应流程,A、E中均含有Na元素,碱性溶液E与0.2molHCl恰好完全反应生成中性的F溶液,则F为NaCl,则n(Na)= n(Cl)= n(HCl)=0.2mol,由三种常见元素组成的化合物 A,与足量的水反应生成B和E,A中应含有C和Na元素,A的质量为9.6g,则第三种元素的质量为9.6g-0.4mol×12g/mol-0.2mol×23g/mol=0.2g,则A为C、H、Na三种元素组成,物质的量分别为0.4mol、0.2mol、0.2mol,则A的化学式为NaHC2,据此分析解答;
Ⅱ.向 NaBr 溶液中通入一定量Cl2,溶液由无色变为红棕色,证明有溴单质生成,发生反应Cl2+2NaBr=2NaCl+ Br2,将分液漏斗中反应后的溶液加入到盛有含有四氯化碳的KI溶液中,取试管振荡,静置后,试管内溶液分层,且下层为紫红色,上层无色,说明试管内由碘单质生成,发生反应为Br2+2KI=2KBr+I2,根据实验中发生的氧化还原反应,结合氧化剂的氧化性强于氧化产物的氧化性分析氧化性强弱,据此分析解答。
Ⅰ.(1)根据分析,组成 A 的非金属元素是碳(C)和氢(H),气体 B 为C2H2,结构简式CH≡CH;
(2)固体A与足量水反应的化学方程式是NaHC2+H2O=NaOH+C2H2↑;
(3)根据分析,D为CO2,一定条件下,气体CO2可能和FeO发生氧化还原反应,CO2中碳元素为+4价,属于碳元素的最高价,具有氧化性,FeO中Fe元素为+2价,具有一定的还原性,可能的化学方程式CO2+2FeO![]() Fe2O3+CO;
Fe2O3+CO;
Ⅱ.(4) 将分液漏斗中反应后的溶液加入到盛有含有四氯化碳的KI溶液中,取试管振荡,静置后,试管内溶液分层,且下层为紫红色,上层无色,说明试管内由碘单质生成,发生反应为Br2+2KI=2KBr+I2,反应中Br2为氧化剂,I2为氧化产物,氧化剂的氧化性强于氧化产物的氧化性,说明氧化性Br2>I2;
(5)为了排除Cl2 对溴置换碘实验的干扰,需确认分液漏斗中通入Cl2 未过量。由于溴单质的密度比水大,在溶液的下层,取分液漏斗中上层少量溶液于试管中,向试管中通入Cl2,若试管中溶液出现红棕色,说明有溴单质生成,可确定氯气未过量。

【题目】常温下浓度均为0.1mol/L 的四种盐溶液,其pH 如表所示,下列说法正确的是( )
序号 | ① | ② | ③ | ④ |
溶液 | CH3COONa | NaHCO3 | Na2CO3 | NaClO |
pH | 8.8 | 9.7 | 11.6 | 10.3 |
A. 将等浓度的CH3COOH 和HClO溶液,pH小的是HClO
B. Na2CO3和NaHCO3溶液中粒子种类不同
C. 溶液水的电离程度:①>②>④>③
D. NaHCO3溶液中:c (Na+) =c (CO32- )+c (HCO3- )+c (H2CO3)
【题目】氢气还原 NO 的反应为![]() 。
。
(1)![]() 的电子式为________。
的电子式为________。
(2)已知几种共价键的键能如下:
共价键 | H-H |
| N-O | H-O |
键能/( | 436 | 946 |
| 464 |
根据上述数据计算,NO的键能![]() =___________。
=___________。
(3)![]() 的反应速率表达式为
的反应速率表达式为![]() (
(![]() 为正反应速率常数,只与温度有关。
为正反应速率常数,只与温度有关。![]() 和
和![]() 为反应级数,取最简正整数)。
为反应级数,取最简正整数)。
为了探究一定温度下 NO、![]() 的浓度对反应速率的影响,测得实验数据如下:
的浓度对反应速率的影响,测得实验数据如下:
序号 |
|
|
|
Ⅰ | 0.10 | 0.10 | 0.414 |
Ⅱ | 0.10 | 0.20 | 0.828 |
Ⅲ | 0.30 | 0.10 | 3.726 |
①![]() 中,
中,![]() =____,
=____,![]() =______。
=______。
②经研究,有人提出上述反应分两步进行:![]() ;
;![]() 。
。
化学总反应由较慢的一步反应决定。
上述反应中,(a)反应较慢,(a)正反应活化能________(填“大于”“小于”或“等于”)(b)正反应活化能。
③1889年,瑞典化学家阿伦尼乌斯根据实验结果,提出了温度与反应速率常数关系的经验公式:![]() [
[![]() 为反应速率常数,
为反应速率常数,![]() 为比例常数,
为比例常数,![]() 为自然对数的底数,
为自然对数的底数,![]() 为气体摩尔常数,
为气体摩尔常数,![]() 为开尔文温度,
为开尔文温度,![]() 为活化能
为活化能![]() ]。
]。![]() 反应达到平衡后,升高温度,正反应速率常数增大的倍数_____(填“大于”“小于”或“等于”)逆反应速率常数增大的倍数。
反应达到平衡后,升高温度,正反应速率常数增大的倍数_____(填“大于”“小于”或“等于”)逆反应速率常数增大的倍数。
(4)一定温度下,在2 L恒容密闭容器中充入2 mol NO(g)、![]() 发生上述反应,混合气体压强随着时间变化关系如图所示。
发生上述反应,混合气体压强随着时间变化关系如图所示。
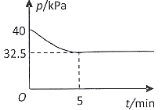
①05 min 内![]() 的平均速率
的平均速率 ![]() =___________________
=___________________![]() 。
。
②该温度下,上述反应的平衡常数![]() =________________
=________________![]() 。
。
③其他条件不变,在10min时向反应体系中再充入1mol NO、![]() ,达到新平衡时NO的平衡转化率 ________________(填“增大”“减小”或“不变”)。
,达到新平衡时NO的平衡转化率 ________________(填“增大”“减小”或“不变”)。
(5)工业上,可以采用电化学方法处理NO。以惰性材料为电极,以硝酸铵溶液为电解质溶液并补充![]() ,电解反应为
,电解反应为![]() 。电解过程中,阳极的电极反应式为_______________________。
。电解过程中,阳极的电极反应式为_______________________。