题目内容
【题目】常温下,向等体积(V0mL)等浓度(0.1 mol .L-1)的盐MCl、NaR、MR溶液中分别加入蒸馏水,使其稀释VmL,稀释过程中,溶液的pH与lg![]() 的关系如图所示。下列有关说法正确的是
的关系如图所示。下列有关说法正确的是
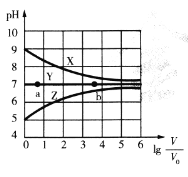
A.曲线X对应的盐为NaR,MCl为强酸强碱盐
B.对于曲线Y,a点水的电离程度比b点小
C.常温下,MOH的电离平衡常数Kb的数量级为10-3
D.曲线Z上任何一点对应溶液中均存在c(H+) =c(OH-) +c( MOH)
【答案】D
【解析】
由题给图象X、Y、Z三条曲线的起始点可知,三种盐溶液分别显碱性、中性、酸性,水溶液显碱性的盐为强碱弱酸盐,水溶液显酸性的盐为强酸弱碱盐,水溶液显中性的盐可能是强酸强碱盐或水解程度相同的弱酸弱碱盐,故曲线X、Y、Z对应的盐分别为NaR、MR、MCl,据此分析解答。
A.根据分析,X为NaR,为弱酸强碱盐,Y为MR,为弱酸弱碱盐,Z为MCl,为强酸弱碱盐,故A错误;
B.曲线Y对应的盐为MR,为中性,为弱酸弱碱盐,随着稀释程度的增大,水的电离程度不变,故b点水的电离程度和a点相同,故B错误;
C.由题图可知,0.1mol.L-1MCl溶液的pH=5,水解平衡常数Kh=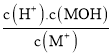 =
=![]() =10-9,根据Kw=Kb×Kh,常温下,MOH的电离平衡常数Kb≈1×10-5,数量级为10-5,故C错误;
=10-9,根据Kw=Kb×Kh,常温下,MOH的电离平衡常数Kb≈1×10-5,数量级为10-5,故C错误;
D.根据分析,Z对应的盐为MCl,属于强酸弱碱盐,曲线Z上任何一点对应溶液中存在质子守恒c(H+) =c(OH-) +c( MOH),故D正确;
答案选D。

练习册系列答案
相关题目