题目内容
【题目】碘及其化合物在生产生活中应用广泛。回答下列问题:
I.单质碘与氟反应可得IF5,实验表明液态IF5具有一定的导电性原因在于IF5的自偶电离(如:2H2OH3O++OH-),IF5的自偶电离方程式为_________。
II.一种回收并利用含碘(I-)废液的工艺流程如下:

(1)含碘废水中碘的存在形式一般有I2、I-。检验是否含I2及I-的方法是_______________。
(2)“沉淀”中生成CuI的离子方程式为_______________。
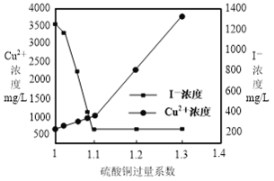
(3)CuSO4的投加量对废水中I-的去除量影响较大,不同投加量(用过量系数表示)下,反应后I-和Cu2+的浓度如图所示,则适宜的CuSO4过量系数应为_______________,分析原因_______________。
(4)反应Ⅰ中生成铁与碘的化合物(其中铁与碘的质量比为21:127),则加入的水的作用是__________,反应Ⅱ的化学方程式是_____________________________。
(5)氯化银复合吸附剂可有效吸附碘离子。氯化银复合吸附剂对碘离子的吸附反应为I-(aq)+AgCl(s) AgI(s)+Cl-(aq),反应达到平衡后溶液中c(Cl-)=0.10molL-1。则溶液中c(I-)= ______molL-1。[Ksp(AgCl)=2.0×10-10,Ksp (AgI)=8.4×10-17]。该方法能去除碘离子的原理是_________。
(6)准确称取产品0.1000g溶于50mL水,加入适量乙酸并加入曙红钠指示剂,然后用0.025mol·L-1AgNO3溶液滴定,至终点时消耗AgNO3溶液22.00mL,则产品中KI的质量分数为____________(保留三位有效数字)。
【答案】2IF5IF4++IF6-, 用CCl4萃取后观察萃取液为紫色,证明含有I2,反复萃取后取水层少许于试管中,加入淀粉及FeCl3溶液,若出现蓝色,则含有I-,或加入AgNO3溶液,若含有黄色沉淀生成,则含有I- 2Cu2++2I-+SO32-+2H2O = 2CuI↓+SO42-+2H+ 1.1 小于1.1则I-去除率较低,大于1.1又会引入较多的重金属离子Cu2+ 催化剂 Fe3I8+4K2CO3 = Fe3O4+8KI+4CO2↑ 4.2×10-8, 原理是AgI溶度积比AgCl的溶度积小,发生沉淀的转化。 91.3%。
【解析】
I.水的电离方程式确定IF5电离方程式,从而确定其阳离子和阴离子;
II.结合流程可以知道回收废液中碘离子的步骤为:先向废液中加入亚硫酸钠、硫酸铜溶液生成CuI沉淀,过滤得到滤渣CuI,然后加入浓硝酸氧化Cul,向氧化产物中加入碘单质、铁屑和水后得到Fe3I8,Fe3I8与碳酸钾溶液发生反应Fe3I8+4K2CO3=Fe3O4+8KI+4CO2↑;过滤后将反应II的滤液经过加热浓缩、冷却结晶、过滤,初步得到碘化钾;因为碘化钾混有可溶性杂质,需要经过洗涤才能得到较纯净的产品,同时为了减少KI的溶解损失,需要用冰水洗涤,最后得到纯净的氯化钾,据此分析。
I.由水的电离方程式知,IF5的自偶电离方程式为:2IF5IF4++IF6-;
II.(1)检验碘可以用淀粉也可以用四氯化碳萃取,检验I-时为防止碘的干扰,需先充分萃取出碘,再在水层中加入淀粉及氧化剂(FeCl3、H2O2及氯水均可),所以用CCl4萃取后观察萃取液为紫色,证明含有I2,反复萃取后取水层少许于试管中,加入淀粉及FeCl3溶液,观察溶液是否出现蓝色,或加入AgNO3溶液,看是否有黄色沉淀生成;
(2)根据流程图,沉淀池中SO32-被氧化为SO42-,Cu2+被还原为Cu+与I-结合为CuI沉淀,离子反应为:2Cu2++2I-+SO32-+H2O = 2CuI↓+SO42-+2H+;
(3)根据图示,当CuSO4过量系数小于1.1时I-去除率较低,大于1.1又会引入较多的重金属离子Cu2+;
(4)反应Ⅰ产物中不含H、O元素,加入水可能是为了加快反应速率,水起催化作用;根据铁与碘的质量比为21:127,可知铁与碘的物质的量比是![]() ,所以反应Ⅰ中生成铁与碘的化合物是Fe3I8;根据流程图反应Ⅱ是Fe3I8、K2CO3生成Fe3O4、KI、CO2;
,所以反应Ⅰ中生成铁与碘的化合物是Fe3I8;根据流程图反应Ⅱ是Fe3I8、K2CO3生成Fe3O4、KI、CO2;
(5)吸附反应为I-(aq) +AgCl(s)AgI(s)+Cl-(aq),反应达到平衡后,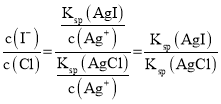 ,则
,则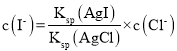 ,去除碘离子的原理是AgI溶度积比AgCl的溶度积小,发生沉淀的转化。
,去除碘离子的原理是AgI溶度积比AgCl的溶度积小,发生沉淀的转化。
(6)依据滴定反应:Ag++I-=AgI↓,KI的质量分数为: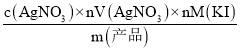 ×100%=
×100%=![]() ×100%=91.3%。
×100%=91.3%。