题目内容
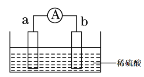
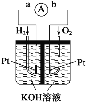
【题目】(1)如图所示,两电极一为碳棒,一为铁片,若电流表的指针发生偏转,且a极上有大量气泡生成,则电子由_____(填“a”或“b”,下同) 极流向_____极,电解质溶液中![]() 移向_____极,a极上的电极反应式为___________________。
移向_____极,a极上的电极反应式为___________________。
(2)氢氧燃料电池是符合绿色化学理念的新型发电装置。如图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定。其正极反应方程式为___________,若将燃料改为CH4,写出其负极反应方程式_________。
(3)图为青铜器在潮湿环境中因发生电化学反应而被腐蚀的原理示意图。

①腐蚀过程中,负极是_________(填图中字母“a”或“b”或“c”);
②环境中的Cl- 扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔粉状锈Cu2(OH)3Cl,其离子方程式为_______________________;
③若生成4.29 g Cu2(OH)3Cl,则理论上耗氧体积为_______L(标况)。
【答案】b a b 2H+ + 2e- = H2↑ O2+2H2O+4e-=4OH- CH4+10OH--8e-=![]() +7H2O c 2Cu2++3OH-+ Cl-==Cu2 (OH)3Cl↓ 0.448
+7H2O c 2Cu2++3OH-+ Cl-==Cu2 (OH)3Cl↓ 0.448
【解析】
在铁、碳、稀硫酸形成的原电池中,气泡应在正极表面产生,由此确定a、b与正、负极的关系,从而得出电子流动的方向、电极反应式及离子迁移;在CH4碱性燃料电池中,通O2的电极为正极,通燃料的电极为负极,由于电解质呈碱性,所以CH4燃烧的最终生成物应为![]() ;青铜器在潮湿环境中发生的电化学反应中,依据电极产物,判断电子得失情况,从而确定正、负极;在利用腐蚀产物进行耗氧量计算时,需从电荷守恒角度分析产物与电子守恒的关系。
;青铜器在潮湿环境中发生的电化学反应中,依据电极产物,判断电子得失情况,从而确定正、负极;在利用腐蚀产物进行耗氧量计算时,需从电荷守恒角度分析产物与电子守恒的关系。
(1)a极上有大量气泡生成,则a极为正极(碳棒),b极为负极(铁片),电子由负极流向正极,即由b极流向a极,电解质溶液中,阴离子向负极移动,即![]() 移向b极,a极上的H+得电子生成H2,电极反应式为2H+ + 2e- = H2↑。答案为:b;a;b;2H+ + 2e- = H2↑;
移向b极,a极上的H+得电子生成H2,电极反应式为2H+ + 2e- = H2↑。答案为:b;a;b;2H+ + 2e- = H2↑;
(2)在氢氧燃料电池中,负极为Pt(通H2),正极为Pt(通O2),正极O2得电子产物与水反应生成OH-,正极反应方程式为O2+2H2O+4e-=4OH-,若将燃料改为CH4,则负极为通CH4的电极,CH4失电子产物与电解质反应生成![]() 和水,负极反应方程式为CH4+10OH--8e-=
和水,负极反应方程式为CH4+10OH--8e-=![]() +7H2O。答案为:O2+2H2O+4e-=4OH-;CH4+10OH--8e-=
+7H2O。答案为:O2+2H2O+4e-=4OH-;CH4+10OH--8e-=![]() +7H2O;
+7H2O;
(3)青铜器在潮湿环境中因发生电化学腐蚀,Cu失电子生成Cu2+,O2得电子产物与水反应生成OH-。
①腐蚀过程中,Cu作负极,负极是c;
②环境中的Cl- 扩散到孔口,并与正极反应产物OH-和负极反应产物Cu2+作用,生成多孔粉状锈Cu2(OH)3Cl,其离子方程式为2Cu2++3OH-+ Cl-==Cu2 (OH)3Cl↓;
③Cu2(OH)3Cl的质量为4.29 g,物质的量为![]() =0.02mol,需消耗0.04molCu2+、0.06molOH-,电极反应式为Cu-2e-==Cu2+,O2+4e-+2H2O==4OH-,则线路中转移电子0.08mol,需消耗O20.02mol,则理论上耗氧体积为0.02mol×22.4L/mol=0.448L(标况)。
=0.02mol,需消耗0.04molCu2+、0.06molOH-,电极反应式为Cu-2e-==Cu2+,O2+4e-+2H2O==4OH-,则线路中转移电子0.08mol,需消耗O20.02mol,则理论上耗氧体积为0.02mol×22.4L/mol=0.448L(标况)。
答案为:c;2Cu2++3OH-+ Cl-==Cu2 (OH)3Cl↓;0.448。

 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案