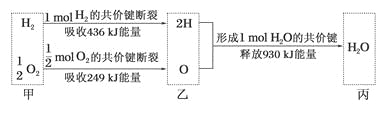
题目内容
【题目】目前,全世界镍的消费量仅次于铜、铝、铅、锌,居有色金属第五位。镍行业发展蕴藏着巨大潜力。
Ⅰ.(1)硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。
①基态Ni2+的核外电子排布式为_________________。
②在[Ni(NH3)6]2+中存在的化学键有(_____________)
A.离子键 B.共价键 C.配位键 D. 氢键 E.σ键 F.π键
Ⅱ.丁二酮肟是检验Ni2+的灵敏试剂。
(2)丁二酮肟分子![]() 中C原子轨道杂类型为________________,1mol丁二酮肟分子所含σ键的数目为_____________。
中C原子轨道杂类型为________________,1mol丁二酮肟分子所含σ键的数目为_____________。
(3)配合物[Ni(CO)4]常温下为液态,易溶于CCl4、苯等有机溶剂。
① [Ni(CO)4]固态时属于________晶体(填晶体类型)。
②[Ni(CO)4]中Ni与CO的C原子形成配位键。不考虑空间构型,[Ni(CO)4]的结构可用示意图表示为_____________ (用“→”表示出配位键) 。
【答案】1s22s22p63s23p63d8 BCE sp3和sp2 15NA 分子 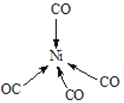
【解析】
(1)①Ni是28号元素,根据原子核外电子排布规律书写Ni2+的基态核外电子排布式;②[Ni(NH3)6] 2+中Ni2+与NH3之间形成配位键、NH3中N、H之间形成极性键;
(2)根据价层电子对互斥理论确定中心原子杂化方式;C-H为碳氢σ键,C-C为碳碳σ键,C=N含有一个碳氮σ键;
(3)①根据合物Ni(CO)4的性质熔点、溶解性判断;②Ni(CO)4中Ni与CO的C原子形成配位键,形成四面体结构,据此分析解答。
Ⅰ.(1)①Ni是28号元素,根据原子核外电子排布规律可知,Ni2+的基态核外电子排布式为1s22s22p63s23p63d8,故答案为:1s22s22p63s23p63d8;
②[Ni(NH3)6] 2+中Ni2+与NH3之间形成配位键、NH3中N、H之间N-H单键,属于共价键,也是σ键,故答案为:BCE ;
Ⅱ.(2)丁二酮肟![]() 分子中甲基上碳原子价层电子对个数是4,且不含孤电子对,为sp3杂化,连接甲基的碳原子含有3个价层电子对,且不含孤电子对,为sp2杂化;已知丁二酮肟的结构式为
分子中甲基上碳原子价层电子对个数是4,且不含孤电子对,为sp3杂化,连接甲基的碳原子含有3个价层电子对,且不含孤电子对,为sp2杂化;已知丁二酮肟的结构式为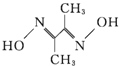 ,分子中含有13个单键,和2个双键,则共含有15个σ键,所以1mol丁二酮肟含有σ键数目为15NA;故答案为:sp3和sp2;15NA;
,分子中含有13个单键,和2个双键,则共含有15个σ键,所以1mol丁二酮肟含有σ键数目为15NA;故答案为:sp3和sp2;15NA;
(3)①因为Ni(CO)4常温下为液态,易溶于CCl4、苯等有机溶剂,根据相似相溶原理知,固态Ni(CO)4属于分子晶体,故答案为:分子;
②Ni(CO)4中Ni与CO的C原子形成配位键,形成四面体结构,其结构图为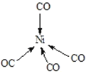 ,故答案为:
,故答案为: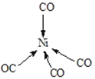 。
。

 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案【题目】某实验室以含镍废料(主要成分为NiO,还含有少量 FeO、Fe2O3、CoO、BaO 和SiO2)为原料制备NixOy 和碳酸钴(CoCO3)的工艺流程如图:
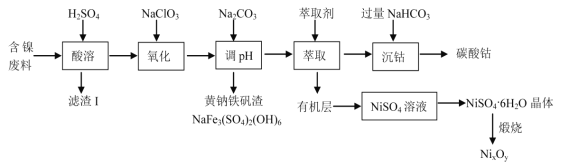
已知有关氢氧化物开始沉淀和沉淀完全的 pH 如表:
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Ni(OH)2 |
开始沉淀的 pH | 1.5 | 6.5 | 7.2 | 7.7 |
沉淀完全的 pH | 3.7 | 9.7 | 9.4 | 9.2 |
请回答以下问题:
(1)“滤渣Ⅰ”主要成分为(填化学式)_____。
(2)“氧化”时(加入 NaClO3)的离子方程式为_____。
(3)加入 Na2CO3 来“调 pH”的目的是生成黄钠铁钒沉淀而除去铁,也可通过加入MO(对应的金属氧化物)来调节 pH 将铁除去,则 pH 控制的范围为_____。
(4)在实验室萃取操作应该在_____中完成(填仪器名称),向水相中加入NaHCO3 时的离子方程式为_________。
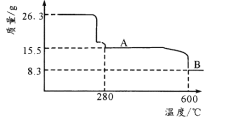
(5)从 NiSO4 溶液获得NiSO4·6H2O 晶体的操作依次是:_____,_________,过滤,洗涤,干燥。“煅烧”时剩余固体质量与温度变化曲线如图,该曲线中 B 段所表示氧化物的名称为_____。
【题目】X、Y、Z、W、R、P、Q是短周期主族元素,部分信息如下表所示:
X | Y | Z | W | R | P | Q | |
原子半径/nm | 0.154 | 0.074 | 0.099 | 0.075 | 0.143 | ||
主要化合价 | -4,+4 | -2 | -1,+7 | -3,+5 | +3 | ||
其他 | 阳离子核外无电子 | 无机非金属材料的主角 | 焰色反应呈黄色 |
(1)R在自然界中有质量数为35和37的两种核素,它们之间的关系是互为___。
(2)Z的单质与水反应的化学方程式是___;R与Q两元素最高价氧化物水化物反应的离子方程式___。
(3)Y与R相比,非金属性较强的是___(用元素符号表示),下列事实能证明这一结论的是___(填字母序号)。
a.常温下Y的单质呈固态,R的单质呈气态
b.稳定性XR>YX4
c.Y与R形成的化合物中Y呈正价
(4)写出工业制取Y的单质的化学方程式___。
(5)反应3X2(g)+P2(g)![]() 2PX3(g)过程中的能量变化如图所示回答下列问题:
2PX3(g)过程中的能量变化如图所示回答下列问题:
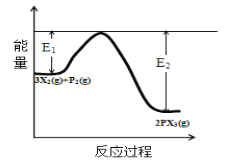
①该反应是___反应(填“吸热”“放热”);
②反应体系中加入催化剂对反应热是否有影响?___,原因是___(从能量说明)
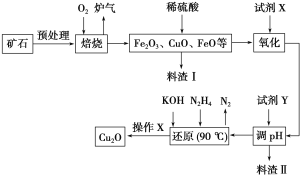
【题目】氧化亚铜(Cu2O)是一种用途广泛的光电材料,某工厂以硫化铜矿石(含CuFeS2、Cu2S等)为原料制取Cu2O的工艺流程如下:
常温下几种物质开始形成沉淀与完全沉淀时的pH如下表:
Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
开始沉淀 | 7.5 | 2.7 | 4.8 |
完全沉淀 | 9.0 | 3.7 | 6.4 |
(1)炉气中的有害气体成分是__________,Cu2S与O2反应时,氧化剂与还原剂的物质的量之比为__________。
(2)若试剂X是H2O2溶液,写出相应反应的离子方程式:________。当试剂X是______时,更有利于降低生产成本。
(3)加入试剂Y调pH时,pH的调控范围是___________。
(4)写出用N2H4制备Cu2O的化学方程式:________,操作X包括_________、洗涤、烘干,其中烘干时要隔绝空气,其目的是____________。
(5)以铜与石墨作电极,电解浓的强碱性溶液可制得纳米级Cu2O,写出阳极上生成Cu2O的电极反应式:__________。