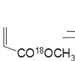
题目内容
【题目】X、Y、Z、W、R、P、Q是短周期主族元素,部分信息如下表所示:
X | Y | Z | W | R | P | Q | |
原子半径/nm | 0.154 | 0.074 | 0.099 | 0.075 | 0.143 | ||
主要化合价 | -4,+4 | -2 | -1,+7 | -3,+5 | +3 | ||
其他 | 阳离子核外无电子 | 无机非金属材料的主角 | 焰色反应呈黄色 |
(1)R在自然界中有质量数为35和37的两种核素,它们之间的关系是互为___。
(2)Z的单质与水反应的化学方程式是___;R与Q两元素最高价氧化物水化物反应的离子方程式___。
(3)Y与R相比,非金属性较强的是___(用元素符号表示),下列事实能证明这一结论的是___(填字母序号)。
a.常温下Y的单质呈固态,R的单质呈气态
b.稳定性XR>YX4
c.Y与R形成的化合物中Y呈正价
(4)写出工业制取Y的单质的化学方程式___。
(5)反应3X2(g)+P2(g)![]() 2PX3(g)过程中的能量变化如图所示回答下列问题:
2PX3(g)过程中的能量变化如图所示回答下列问题:
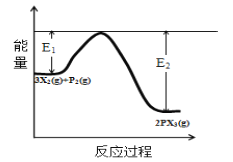
①该反应是___反应(填“吸热”“放热”);
②反应体系中加入催化剂对反应热是否有影响?___,原因是___(从能量说明)
【答案】同位素 2Na+2H2O=2NaOH+H2↑ 3H++Al(OH)3=Al3++3H2O Cl b、c SiO2+2C![]() Si+2CO↑ 放热 不影响 催化剂不改变平衡的移动
Si+2CO↑ 放热 不影响 催化剂不改变平衡的移动
【解析】
X、Y、Z、W、R、P、Q是短周期主族元素,X阳离子核外无电子,则X为H元素;Y的化合价主要为-4,+4,是无机非金属材料的主角,则Y为Si元素;Z焰色反应呈黄色,则Z为Na元素;R的主要化合价为-1,+7,则R为Cl元素;W有-2价,处于VIA族,原子半径小于Cl,故W为O元素;Q主要化合价为+3价,原子半径Na> Q > Cl ,则Q为Al元素;P有-3、+5价,处于VA族,原子半径小于Cl,故P为N元素;
(1)R在自然界中有质量数为35和37的两种核素,中子数不同,二者互为同位素;
(2)Z为Na元素,钠与水反应生成氢氧化钠和氢气,反应方程式为:2Na+2H2O=2NaOH+H2↑,R与Q两元素最高价氧化物水化物分别为HClO4、Al(OH)3,二者反应离子方程式为: 3H++Al(OH)3=Al3++3H2O;
(3)Y为Si元素,R为Cl元素,同周期自左而右,非金属性增强,所以非金属性Si< C1;
a.状态属于物理性质,不能说明元素的非金属性强弱,a错误;
b.非金属越强,氢化物越稳定,稳定性XR > YX4 ,说明X的非金属性强,b正确;
c.Y与R形成的化合物中Y呈正价,说明R吸引电子能力强, R的非金属性强,c正确;
故选bc;
(4)工业制取Y(Si)的单质用SiO2和C在高温下反应,化学方程式为:SiO2+2C![]() Si+2CO↑;
Si+2CO↑;
(5)①由图可以知道,反应物总能量高于生成物总能量,则该反应是放热反应;
②催化剂可以降低反应的活化能,加快化学反应速率,但不改变平衡的移动,不影响反应热;

 名校课堂系列答案
名校课堂系列答案【题目】下面是元素周期表的结构,用化学用语完成下列问题。
① | |||||||||||||||||
② | ③ | ④ | |||||||||||||||
⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |||||||||||||
(1)表中有编号的元素中化学性质最不活泼的,其原子结构示意图为__;④与⑤按照原子个数比1∶1形成的化合物中含有的化学键有___。
(2)①与②形成的最简单化合物的空间构型为__,将此化合物与⑧的单质混合于一干燥的集气瓶,密封后放在光亮处一段时间后,观察到的现象是__。
(3)由③形成的单质的电子式为__;⑤与⑦的最低价形成的化合物的电子式为__。
(4)⑧的最高价氧化物对应的水化物的化学式是___;①分别与④、⑦形成的简单化合物的稳定性由强到弱的顺序是__。
(5)④、⑥、⑧三种元素的原子形成的简单离子中半径由大到小的顺序是__。
(6)运用你掌握的化学理论,设计一个实验,证明⑦的非金属性比②强__(用化学方程式表示出反应原理)。