题目内容
【题目】根据下列信息判断氢气燃烧生成水时的热量变化,其中一定正确的是
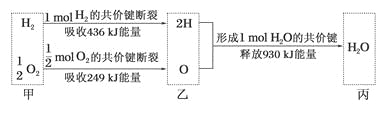
A.H2O分解为H2与O2时放出热量
B.1molH2与0.5molO2完全反应生成1mol H2O时放出热量245 kJ
C.甲、乙、丙中物质所具有的总能量大小关系为甲>乙>丙
D.氢气和氧气的总能量小于水的能量
【答案】B
【解析】
A.△H=反应物键能和-生成物键能和=436kJ/mol+249kJ/mol-930kJ/mol=-245kJ/mol,反应放热,所以水分解吸收热量,A项错误;
B.据A分析,生成1mol水时放出245kJ的热量,B项正确;
C. 断键吸收能量,成键释放能量,该反应是放热反应,所以甲、乙、丙中物质所具有的总能量大小关系为乙>甲>丙,C项错误;
D.反应放热,反应物总能量高于生成物,即氢气和氧气的总能量大于水的能量,D项错误;
答案选B。

【题目】双氧水是一种重要的氧化剂、漂白剂和消毒剂。它在NCP疫情控制中发挥重要作用。
(1)工业生产双氧水常采用催化剂—乙基蒽醌法,其反应过程如图所示:

写出工业制备H2O2(1)反应的热化学方程式___。
(2)过氧化氢还可以通过电解-水解法制得。工业上用Pt作电极材料,电解硫酸氢铵饱和溶液得到过二硫酸铵[(NH4)2S2O8],然后加入适量硫酸以水解过二硫酸铵即得到过氧化氢。写出阳极的电极反应式___;整个过程的总化学方程式是___。
(3)某课题组在298K时研究H2O2+2HI=2H2O+I2反应速率的影响因素,实验结果如下表:
试验编号 | 1 | 2 | 3 | 4 | 5 |
c(HI)/mol·L-1 | 0.100 | 0.200 | 0.300 | 0.100 | 0.100 |
c(H2O2)/mol·L-1 | 0.100 | 0.100 | 0.100 | 0.200 | 0.300 |
v/mol·L-1·s-1 | 0.00760 | 0.0153 | 0.0227 | 0.0151 | 0.0228 |
分析上述数据,写出反应速率与物质浓度的关系式___;该反应的速率常数(k)的值为___。
(4)过氧化氢是强氧化剂,在许多反应中有重要的应用。在一定温度下,将0.4molN2H4(g)和0.6molH2O2(g)装入2L固定容积的容器中,发生反应N2H4(g)+2H2O2(g)![]() N2(g)+4H2O(g) ΔH<0,当N2H4(g)的转化率为50%时反应达到平衡,该反应的化学平衡常数的值为___。
N2(g)+4H2O(g) ΔH<0,当N2H4(g)的转化率为50%时反应达到平衡,该反应的化学平衡常数的值为___。
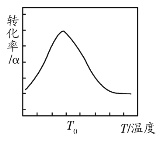
实验测得反应中N2H4(g)的转化率(α)与温度(T)的关系如图所示,分析说明温度高于T0时,N2H4(g)的转化率下降的原因是___。