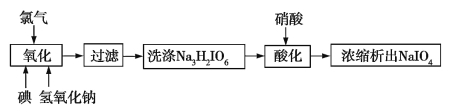
题目内容
【题目】25℃时,有c(CH3COOH)+c(CH3COO-)=0.1molL-1的一组醋酸、醋酸钠混合溶液,溶液中c(CH3COOH)、c(CH3COO-)与pH的关系如图所示.下列有关溶液中离子浓度关系的叙述正确的是( )
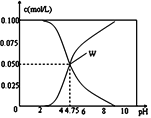
A. pH=5.5的溶液中:c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-)
B. 该温度下醋酸的电离平衡常数为10-4.75
C. pH=3.5的溶液中:c(Na+)+c(H+)+c(OH-)+c(CH3COOH)=0.1molL-1
D. 向W点所表示的溶液中加入等体积的0.05molL﹣1NaOH溶液:c(H+)=c(CH3COOH)+c(OH﹣)
【答案】B
【解析】A.由图可知,pH=5.5的溶液,显酸性,且c(CH3COO-)>c(CH3COOH),即c(CH3COO-)>c(CH3COOH)>c(H+)>c(OH-),故A错误;B.W点c(CH3COOH)=c(CH3COO-),平衡常数K=![]() =10-4.75molL-1,故B正确;C.由电荷守恒及c(CH3COOH)+c(CH3COO-)=0.1molL-1可知,c(Na+)+c(H+)-c(OH-)+c(CH3COOH)=c(CH3COO-)+c(CH3COOH)=0.1mol/L,故C错误;D.向W点所表示溶液中通入0.05molHCl气体,原有平衡被打破,建立起了新的平衡,溶液中电荷守恒关系为:c(Na+)+c(H+)=c(CH3COO-)+c(OH-)+c(Cl-);物料守恒关系为:2c(Cl-)=c(CH3COO-)+c(CH3COOH)=0.1molL-1,得2c(Na+)+2c(H+)=3c(CH3COO-)+2c(OH-)+c(CH3COOH)
=10-4.75molL-1,故B正确;C.由电荷守恒及c(CH3COOH)+c(CH3COO-)=0.1molL-1可知,c(Na+)+c(H+)-c(OH-)+c(CH3COOH)=c(CH3COO-)+c(CH3COOH)=0.1mol/L,故C错误;D.向W点所表示溶液中通入0.05molHCl气体,原有平衡被打破,建立起了新的平衡,溶液中电荷守恒关系为:c(Na+)+c(H+)=c(CH3COO-)+c(OH-)+c(Cl-);物料守恒关系为:2c(Cl-)=c(CH3COO-)+c(CH3COOH)=0.1molL-1,得2c(Na+)+2c(H+)=3c(CH3COO-)+2c(OH-)+c(CH3COOH)
,c(Na+)=0.05mol/L,c(CH3COOH)+c(CH3COO-)=0.1mol/L,所以得c(H+)═c(CH3COO-)+c(OH-),故D错误;故选B。