ЬтФПФкШн
ЁОЬтФПЁП[2017ЬьНђОэ]H2SКЭSO2ЛсЖдЛЗОГКЭШЫЬхНЁПЕДјРДМЋДѓЕФЮЃКІЃЌЙЄвЕЩЯВЩШЁЖржжЗНЗЈМѕЩйетаЉгаКІЦјЬхЕФХХЗХЃЌЛиД№ЯТСаЗНЗЈжаЕФЮЪЬтЁЃ
ЂёЃЎH2SЕФГ§ШЅ
ЗНЗЈ1ЃКЩњЮяЭбH2SЕФдРэЮЊЃК
H2S+Fe2(SO4)3 ![]() SЁ§+2FeSO4+H2SO4
SЁ§+2FeSO4+H2SO4
4FeSO4+ O2+2H2SO4![]() 2Fe2(SO4)3 +2H2O
2Fe2(SO4)3 +2H2O
ЃЈ1ЃЉСђИЫОњДцдкЪБЃЌFeSO4БЛбѕЛЏЕФЫйТЪЪЧЮоОњЪБЕФ5ЁС105БЖЃЌИУОњЕФзїгУЪЧ______________ЁЃ
ЃЈ2ЃЉгЩЭМ3КЭЭМ4ХаЖЯЪЙгУСђИЫОњЕФзюМбЬѕМўЮЊ______________ЁЃШєЗДгІЮТЖШЙ§ИпЃЌЗДгІЫйТЪЯТНЕЃЌЦфдвђЪЧ______________ЁЃ
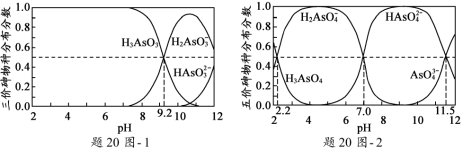
ЗНЗЈ2ЃКдквЛЖЈЬѕМўЯТЃЌгУH2O2бѕЛЏH2S
ЃЈ3ЃЉЫцзХВЮМгЗДгІЕФn(H2O2)/n(H2S)БфЛЏЃЌбѕЛЏВњЮяВЛЭЌЁЃЕБn(H2O2)/n(H2S)=4ЪБЃЌбѕЛЏВњЮяЕФЗжзгЪНЮЊ__________ЁЃ
ЂђЃЎSO2ЕФГ§ШЅ
ЗНЗЈ1ЃЈЫЋМѕЗЈЃЉЃКгУNaOHЮќЪеSO2ЃЌВЂгУCaOЪЙNaOHдйЩњ
NaOHШмвК![]() Na2SO3ШмвК
Na2SO3ШмвК
ЃЈ4ЃЉаДГіЙ§ГЬЂйЕФРызгЗНГЬЪНЃК____________________________ЃЛCaOдкЫЎжаДцдкШчЯТзЊЛЏЃК
CaO(s)+ H2O (l) ![]() Ca(OH)2(s)
Ca(OH)2(s)![]() Ca2+(aq)+2OH(aq)
Ca2+(aq)+2OH(aq)
ДгЦНКтвЦЖЏЕФНЧЖШЃЌМђЪіЙ§ГЬЂкNaOHдйЩњЕФдРэ____________________________________ЁЃ
ЗНЗЈ2ЃКгУАБЫЎГ§ШЅSO2
ЃЈ5ЃЉвбжЊ25ЁцЃЌNH3ЁЄH2OЕФKb=1.8ЁС105ЃЌH2SO3ЕФKa1=1.3ЁС102ЃЌKa2=6.2ЁС108ЁЃШєАБЫЎЕФХЈЖШЮЊ2.0 molЁЄL1ЃЌШмвКжаЕФc(OH)=_________________ molЁЄL1ЁЃНЋSO2ЭЈШыИУАБЫЎжаЃЌЕБc(OH)НЕжС1.0ЁС107 molЁЄL1ЪБЃЌШмвКжаЕФc(![]() )/c(
)/c(![]() )=___________________ЁЃ
)=___________________ЁЃ
ЁОД№АИЁПЃЈ1ЃЉНЕЕЭЗДгІЛюЛЏФмЃЈЛђзїДпЛЏМСЃЉ
ЃЈ2ЃЉ30 ЁцЁЂpH=2.0 ЕААзжЪБфадЃЈЛђСђИЫОњЪЇШЅЛюадЃЉ
ЃЈ3ЃЉH2SO4
ЃЈ4ЃЉ2OH+SO2![]()
![]() +H2O
+H2O
![]() гыCa2+ЩњГЩCaSO3ГСЕэЃЌЦНКтЯђе§ЯђвЦЖЏЃЌгаNaOHЩњГЩ
гыCa2+ЩњГЩCaSO3ГСЕэЃЌЦНКтЯђе§ЯђвЦЖЏЃЌгаNaOHЩњГЩ
ЃЈ5ЃЉ6.0ЁС103 0.62
ЁОНтЮіЁПЃЈ1ЃЉИљОнСђИЫОњДцдкЪБЕФЗДгІЫйТЪЪЧЮоОњЪБЕФ5ЁС105БЖПЩжЊЃЌЗДгІЫйТЪЯджјдіДѓЃЌдђСђИЫОњЕФзїгУЪЧзїДпЛЏМСЃЌНЕЕЭСЫЗДгІЕФЛюЛЏФмЁЃ
ЃЈ2ЃЉИљОнЭМ3ПЩжЊЃЌЮТЖШ30ЁцзѓгвЪБЃЌбѕЛЏЫйТЪзюДѓЃЌИљОнЭМ4ПЩжЊЃЌpH=2.0ЪБбѕЛЏЫйТЪзюДѓЃЌЫљвдЪЙгУСђИЫОњЕФзюМбЬѕМўЮЊ30ЁцЁЂpH=2.0ЃЛШєЗДгІЮТЖШЙ§ИпЃЌСђИЫОњЕААзжЪБфадЪЇШЅЛюаддьГЩЗДгІЫйТЪЯТНЕЁЃ
ЃЈ3ЃЉИљОнЛЏКЯМлЩ§НЕЃЌЕБn(H2O2)/n(H2S)=4ЪБЃЌ4 mol H2O2зЊвЦ8 molЕчзгЃЌдђ1 mol H2SвВзЊвЦ8 molЕчзгЃЌЛЏКЯМлДг2МлЩ§ИпЕН+6МлЃЌЫљвдбѕЛЏВњЮяЮЊH2SO4ЁЃ
ЃЈ4ЃЉЙ§ГЬЂйЪЧNaOHгыSO2ЕФЗДгІЃЌЗДгІЕФРызгЗНГЬЪНЮЊ2OH+SO2![]()
![]() +H2OЃЛИљОнCaOдкЫЎжаЕФзЊЛЏЃКCaO(s)+H2O(l)
+H2OЃЛИљОнCaOдкЫЎжаЕФзЊЛЏЃКCaO(s)+H2O(l)![]() Ca(OH)2(s)
Ca(OH)2(s)![]() Ca2+(aq)+2OH(aq)ЃЌЙ§ГЬЂкжаNa2SO3МгШыCaOКѓЃЌ
Ca2+(aq)+2OH(aq)ЃЌЙ§ГЬЂкжаNa2SO3МгШыCaOКѓЃЌ![]() гыCa2+ЩњГЩCaSO3ГСЕэЃЌЦНКтЯђе§ЯђвЦЖЏЃЌгаNaOHЩњГЩЁЃ
гыCa2+ЩњГЩCaSO3ГСЕэЃЌЦНКтЯђе§ЯђвЦЖЏЃЌгаNaOHЩњГЩЁЃ
ЃЈ5ЃЉИљОнNH3ЁЄH2OЕФKb=1.8ЁС105ПЩжЊЃЌ![]() =1.8ЁС105ЃЌЕБАБЫЎЕФХЈЖШЮЊ2.0 molЁЄL1ЪБЃЌШмвКжаЕФc(OH)= c(
=1.8ЁС105ЃЌЕБАБЫЎЕФХЈЖШЮЊ2.0 molЁЄL1ЪБЃЌШмвКжаЕФc(OH)= c(![]() )=
)=![]() =6.0ЁС103 molЁЄL1ЁЃ
=6.0ЁС103 molЁЄL1ЁЃ
ИљОнH2SO3ЕФKa2=6.2ЁС108ПЩжЊЃЌ![]() =6.2ЁС108ЃЌЕБc(OH)НЕжС1.0ЁС107 molЁЄL1ЃЌдђc(H+)=1.0ЁС107 molЁЄL1ЃЌШмвКжаЕФc(
=6.2ЁС108ЃЌЕБc(OH)НЕжС1.0ЁС107 molЁЄL1ЃЌдђc(H+)=1.0ЁС107 molЁЄL1ЃЌШмвКжаЕФc(![]() )/c(
)/c(![]() )=0.62ЁЃ
)=0.62ЁЃ

 дФЖСПьГЕЯЕСаД№АИ
дФЖСПьГЕЯЕСаД№АИЁОЬтФПЁПЯТСаГТЪіIЁЂIIе§ШЗВЂЧвгавђЙћЙиЯЕЕФЪЧ (ЁЁЁЁ)
бЁЯю | ГТЪіI | ГТЪіII |
A | ТСПЩвдЗжБ№КЭNaOHШмвКЁЂбЮЫсЗДгІ | ТСМШгаН№ЪєадгжгаЗЧН№Ъєад |
B | Na2CO3ПЩвджЦЮИвЉ | Na2CO3ПЩвдКЭбЮЫсЗДгІ |
C | гВТСЪЧКЯН№ | ЦфШлЕуБШН№ЪєТСЕФШлЕуИп |
D | Na2O2ОпгаЧПбѕЛЏад | Na2O2ПЩвдзїЮЊЦЏАзМС |
A. A B. B C. C D. D