题目内容
【题目】标准状况下有:①6.72L CH4,②3.01×1023个HCl分子,③13.6g H2S,④0. 2molNH3。下列对这四种气体相关量的比较不正确的是
A. 体积:②>③>①>④ B. 密度:②>③>④>①
C. 质量:②>③>①>④ D. 氢原子数:①>④>③>②
【答案】D
【解析】试题分析:A.甲烷的体积是6.72L,3.01×1023个HCl分子的体积=![]() ×22.4mol/L=11.2L,13.6g H2S的体积=
×22.4mol/L=11.2L,13.6g H2S的体积=![]() ×22.4L/mol=8.96L,0.2mol NH3的体积=0.2mol×22.4L/mol=4.48L,所以气体体积大小顺序是②>③>①>④,故A正确;B.相同条件下,气体摩尔体积相同,根据ρ=M/Vm知,密度与其相对分子质量成正比,所以密度大小顺序是②>③>④>①,故B正确;C.甲烷的质量=
×22.4L/mol=8.96L,0.2mol NH3的体积=0.2mol×22.4L/mol=4.48L,所以气体体积大小顺序是②>③>①>④,故A正确;B.相同条件下,气体摩尔体积相同,根据ρ=M/Vm知,密度与其相对分子质量成正比,所以密度大小顺序是②>③>④>①,故B正确;C.甲烷的质量=![]() × 16 g/mol = 4.8g,氯化氢的质量=
× 16 g/mol = 4.8g,氯化氢的质量=![]() ×36.5g/mol=18.25g,硫化氢的质量是13.6g,氨气的质量=0.2mol×17g/mol=3.4g,所以质量大小顺序是②>③>①>④,故C正确;D.根据A知,这几种气体的物质的量分别是:甲烷的体积是6.72L其物质的量是0.3mol,氢原子的物质的量是1.2mol;3.01×1023个HCl分子的体积=11.2L,其物质的量是0.5mol,氢原子的物质的量是0.5mol;13.6g H2S的体积=8.96L,其物质的量是0.4mol,氢原子的物质的量是0.8mol;氨气的物质的量是0.2mol,氢原子的物质的量是0.6mol,氢原子个数大小顺序是①>③>④>②,故D错误。故选D。
×36.5g/mol=18.25g,硫化氢的质量是13.6g,氨气的质量=0.2mol×17g/mol=3.4g,所以质量大小顺序是②>③>①>④,故C正确;D.根据A知,这几种气体的物质的量分别是:甲烷的体积是6.72L其物质的量是0.3mol,氢原子的物质的量是1.2mol;3.01×1023个HCl分子的体积=11.2L,其物质的量是0.5mol,氢原子的物质的量是0.5mol;13.6g H2S的体积=8.96L,其物质的量是0.4mol,氢原子的物质的量是0.8mol;氨气的物质的量是0.2mol,氢原子的物质的量是0.6mol,氢原子个数大小顺序是①>③>④>②,故D错误。故选D。

 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案【题目】(1)一定温度下,Ksp[Mg3(PO4)2]=6.0×10-29,Ksp[Ca3(PO4)2]=6.0×10-26。向浓度均为0.20mol/L的MgCl2和CaCl2混合溶液中逐滴加人Na3P04,先生成___________沉淀(填化学式);当测得溶液其中一种金属阳离子沉淀完全(浓度小于10-5mol/L)时,溶液中的另一种金属阳离子的物质的量浓度c=____________mol/L。
(2)毒重石的主要成分BaCO3(含Ca2+、Mg2+、Fe3+等杂质),实验室利用毒重石制备BaCl2·2H2O的流程如下:
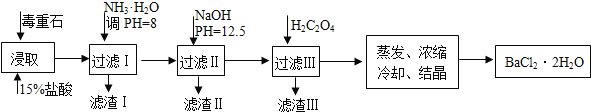
①毒重石用盐酸浸取前需充分研磨,目的是_____________________。
②加入NH3·H2O调节PH=8可除去_____________(填离子符号),滤渣II中含____________(填化学式)。加入H2C2O4时应避免过量,原因是_________________。
Ca2+ | Mg2+ | Fe3+ | |
开始沉淀时的pH | 11.9 | 9.1 | 1.9 |
完全沉淀时的pH | 13.9 | 11.1 | 3.7 |
已知:Ksp(BaC2O4)=1.6×10-7,Ksp(CaC2O4)=2.3×10-9
(3)已知25℃时,CaSO4在水中的沉淀溶解平衡曲线如图所示,向100mL该条件下的CaSO4饱和溶液中加入400mL0.01mol/LNa2SO4溶液,下列叙述正确的是

A.溶液中析出CaSO4固体沉淀,最终溶液中c(SO42-)比原来的大
B.溶液中无沉淀析出,溶液中c(Ca2+)、c(SO42-)都变小
C.溶液中析出CaSO4固体沉淀.溶液中c(Ca2+)、c(SO42-)都变小
D.溶液中无沉淀析出,但最终溶液中c(SO42-)比原来的大