题目内容
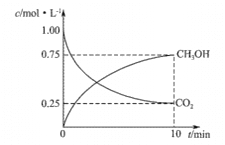
【题目】甲醇是一种可再生能源,具有广泛的开发和应用前景。工业上一般采用下列反应合成甲醇:CO2(g)+3H(g)![]() CH3OH(g)+H2O(g)。在体积为2L的密闭容器中,充入2molCO2和9molH2,测得CO2(g)和CH3OH(g)浓度随时间变化如图所示:
CH3OH(g)+H2O(g)。在体积为2L的密闭容器中,充入2molCO2和9molH2,测得CO2(g)和CH3OH(g)浓度随时间变化如图所示:
(1)该反应的平衡常数K表达式为___________。
(2)0~10min时间内,该反应的平均反应速率v(H2O)=_______________,H2的转化率为_____________。
(3)下列叙述中,能说明反应已达到化学平衡状态的是______(填字母)。
A.容器内CO2、H2、CH3OH、H2O(g)的浓度之比为1:3:1:1
B.v(CO2)正:v(H2)逆=1:3
C.平衡常数K保持不变
D.混合气体的平均相对分子质量保持不变
(4)已知在常温常压下:
①2CH3OH(l)+3O2(g)==2CO2(g)+4H2O(l) △H1 =-1452.8kJ·mol-1
②2CO(g)+O2(g)=2CO2(g) △H2 =-566.0kJ·mol-1
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:____________________________。
(5)中国科学院长春应用化学研究所在甲醇燃料电池技术方面获得新突破,组装出了自呼吸电池及主动式电堆。甲醇燃料电池的工作原理如下图所示:
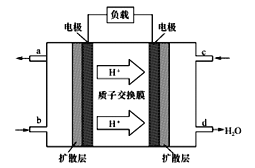
①该电池工作时,c口通人的物质为_____________。
②该电池负极的电极反应式为______________________________。
【答案】 ![]() 0.075 mol/(L·min) 50% BD CH3OH(l)+O2(g)=2H2O(l)+CO(g) ΔH=-443.4 kJ/mol O2(或空气) CH3OH+H2O-6e-=CO2+6H+
0.075 mol/(L·min) 50% BD CH3OH(l)+O2(g)=2H2O(l)+CO(g) ΔH=-443.4 kJ/mol O2(或空气) CH3OH+H2O-6e-=CO2+6H+
【解析】(1)本题考查平衡常数的表达式,根据化学平衡常数的定义,K![]() ;(2)本题考查化学反应速率的计算以及化学平衡的计算,根据图像以及化学反应速率的数学表达式,v(CO2)=(1.00-0.25)/10mol/(L·min)=0.075 mol/(L·min),根据化学反应速率之比等于化学计量数之比,因此有v(CO2)=v(H2O)=0.075mol/(L·min),消耗CO2的物质的量为(1-0.25)×2mol=1.5mol,则 消耗氢气的物质的量为1.5×3mol=4.5mol,即氢气的转化率为4.5/9×100%=50%;(3)本题考查化学平衡状态的判断,A、根据图像,达到平衡时,四种物质的浓度不等于1:3:1:1,故A错误;B、v(CO2)正,反应向正反应方向进行,v(H2)逆,反应向逆反应方向进行,且两者反应速率之比等于化学计量数之比,v(CO2)正:v(H2)逆=1:3,说明反应达到平衡,故B正确;C、化学平衡常数只受温度的影响,温度不变,化学平衡常数不变,因此化学平衡常数不变,不能说明反应达到平衡,故C错误;D、根据M=m/n,组分都是气体,则气体质量不变,反应先后气体系数之和不相等,则当n不变时,即M不变时,说明反应达到平衡,故D正确;(4)本题考查热化学反应方程式的计算,根据盖斯定律,因此有(①-②)/2得出CH3OH(l)+O2(g)=2H2O(l)+CO(g) ΔH=-443.4 kJ/mol;(5)本题考查燃料电池以及电极反应式的书写,①根据H+移动的方向,H+从负极移向正极,通燃料的一极为负极,通氧气的一极为正极,即c口通入的是O2或空气;②环境是酸性,因此负极反应式为CH3OH+H2O-6e-=CO2+6H+。
;(2)本题考查化学反应速率的计算以及化学平衡的计算,根据图像以及化学反应速率的数学表达式,v(CO2)=(1.00-0.25)/10mol/(L·min)=0.075 mol/(L·min),根据化学反应速率之比等于化学计量数之比,因此有v(CO2)=v(H2O)=0.075mol/(L·min),消耗CO2的物质的量为(1-0.25)×2mol=1.5mol,则 消耗氢气的物质的量为1.5×3mol=4.5mol,即氢气的转化率为4.5/9×100%=50%;(3)本题考查化学平衡状态的判断,A、根据图像,达到平衡时,四种物质的浓度不等于1:3:1:1,故A错误;B、v(CO2)正,反应向正反应方向进行,v(H2)逆,反应向逆反应方向进行,且两者反应速率之比等于化学计量数之比,v(CO2)正:v(H2)逆=1:3,说明反应达到平衡,故B正确;C、化学平衡常数只受温度的影响,温度不变,化学平衡常数不变,因此化学平衡常数不变,不能说明反应达到平衡,故C错误;D、根据M=m/n,组分都是气体,则气体质量不变,反应先后气体系数之和不相等,则当n不变时,即M不变时,说明反应达到平衡,故D正确;(4)本题考查热化学反应方程式的计算,根据盖斯定律,因此有(①-②)/2得出CH3OH(l)+O2(g)=2H2O(l)+CO(g) ΔH=-443.4 kJ/mol;(5)本题考查燃料电池以及电极反应式的书写,①根据H+移动的方向,H+从负极移向正极,通燃料的一极为负极,通氧气的一极为正极,即c口通入的是O2或空气;②环境是酸性,因此负极反应式为CH3OH+H2O-6e-=CO2+6H+。

 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案【题目】已知草酸晶体(H2C2O4·XH2O)可溶于水,并可与酸性高锰酸钾溶液完全反应:2KMnO4+5H2C2O4+3H2SO4==K2SO4+2MnSO4+10CO2↑+8H2O。现用氧化还原滴定法测定草酸晶体的结晶水分子数X,步骤如下:
①用分析天平称取草酸晶体1.260g,将其配制成100.00mL待测草酸溶液
②用移液管移取25.00mL待测草酸溶液于锥形瓶中,并加入适量硫酸酸化
③用浓度为0.1000mol/L的KMnO4标准溶液进行滴定,三次结果如下:
第一次滴定 | 第二次滴定 | 第三次滴定 | |
待测溶液体积(mL) | 25.00 | 25.00 | 25.00 |
标准溶液体积(mL) | 9.99 | 10.01 | 10.00 |
已知H2C2O4的相对分子质量为90,请回答下列问题:
(1)滴定时,KMnO4标准溶液应该装在________(填酸式或碱式)滴定管中。
(2)在整个实验过程中,不需要的仪器或用品是______(填序号)。
①100mL容量瓶②烧杯③滴定管夹④漏斗⑤玻璃棒⑥托盘天平
(3)到达滴定终点的标志是____________________________________________。
(4)根据上述数据计算X=________________。
(5)误差分析(填偏高、偏低或无影响):
①若滴定开始时仰视滴定管刻度,滴定结束时俯视滴定管刻度,则X值________;
②若KMnO4标准溶液浓度偏低,则X值_________;
③若锥形瓶洗净后瓶内还残留有少量蒸馏水,则X值____________。