题目内容
【题目】氮氧化合物是目前造成大气污染的主要气体,而汽车尾气中就含有NO 等多种污染气体。汽车尾气里含有的NO气体是由于内燃机燃烧的高温引起氮气和氧气反应所致。请结合所学知识回答下列问题:
(1) 已知:N2(g)+2O2(g)![]() 2NO2(g) △H1=+67.8 kJ/mol
2NO2(g) △H1=+67.8 kJ/mol
2NO2(g)![]() O2(g)+2NO(g) △H2=+116.2 kJ/mol
O2(g)+2NO(g) △H2=+116.2 kJ/mol
则N2(g)+O2(g)![]() 2NO(g) △H=_________kJ/mol;汽车启动后,气缸温度越高,单位时间内NO 的排放量越大,分析其原因为_____________
2NO(g) △H=_________kJ/mol;汽车启动后,气缸温度越高,单位时间内NO 的排放量越大,分析其原因为_____________
(2) 若反应N2(g)+O2(g)![]() 2NO(g)是在恒容条件下进行,下列能说明该反应已达到平衡状态的是________
2NO(g)是在恒容条件下进行,下列能说明该反应已达到平衡状态的是________
a.2υ正(N2)= υ逆(NO) b.混合气体密度不变
c.生成1molO2的同时生成2molNO d.混合气体平均相对分子质量不变
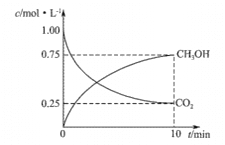
(3) 汽车尾气净化反应:2NO(g)+2CO(g)![]() N2(g)+2CO2(g) △H= -746.5 kJ/mol,若将0.20molNO和0.10molCO充入一个容积恒定为1L 的密闭容器中,在不同条件下,反应过程中部分物质的浓度变化状况如图所示:
N2(g)+2CO2(g) △H= -746.5 kJ/mol,若将0.20molNO和0.10molCO充入一个容积恒定为1L 的密闭容器中,在不同条件下,反应过程中部分物质的浓度变化状况如图所示:

①该反应能自发进行的条件为_____ (填“高温”、“低温”或“任意温度”);
②在6~9 min 内,以CO 表示的平均反应速率 υ(CO)=________mol·L-l·min-1;
③第12min时改变的反应条件为_________ (填“升高温度”或“降低温度”);
④反应在第24min时的平衡常数K=____________(只列出计算式,无需计算结果),若保持温度不变,再向容器中充入CO、N2 各0.060mol,平衡将_________移动(填“正向”、“逆向”或“不”)。
【答案】 +184.0 温度升高,反应速率加快;且温度升高有利于平衡正向移动 ac 低温 0.0067 升高温度 ![]() 逆向
逆向
【解析】试题分析:本题考查盖斯定律的应用、化学平衡的标志、化学平衡图像的分析、外界条件对化学反应速率和化学平衡的影响、化学反应速率和化学平衡常数的计算、化学反应自发性的判断。
(1)对反应编号,N2(g)+2O2(g)![]() 2NO2(g)△H1=+67.8kJ/mol(①式)
2NO2(g)△H1=+67.8kJ/mol(①式)
2NO2(g)![]() O2(g)+2NO(g)△H2=+116.2kJ/mol(②式)
O2(g)+2NO(g)△H2=+116.2kJ/mol(②式)
应用盖斯定律,将①式+②式得,N2(g)+O2(g)![]() 2NO(g)△H=ΔH1+ΔH2=(+67.8kJ/mol)+(+116.2kJ/mol)=+184.0kJ/mol。汽车启动后,气缸温度越高,单位时间内NO的排放量越大,其原因是:温度升高,反应速率加快;且温度升高有利于平衡正向移动。
2NO(g)△H=ΔH1+ΔH2=(+67.8kJ/mol)+(+116.2kJ/mol)=+184.0kJ/mol。汽车启动后,气缸温度越高,单位时间内NO的排放量越大,其原因是:温度升高,反应速率加快;且温度升高有利于平衡正向移动。
(2)a项,2υ正(N2)=υ逆(NO)表示正、逆反应速率相等,能说明反应已达到平衡状态;b项,根据质量守恒定律,混合气体的总质量始终不变,在恒容容器中,混合气体的密度始终不变,混合气体的密度不变不能说明反应已达到平衡状态;c项,生成1molO2一定消耗2molNO,生成1molO2的同时生成2molNO,说明各物质的浓度保持不变,能说明反应已达到平衡状态;d项,根据质量守恒定律,混合气体的总质量始终不变,该反应反应前后气体分子数不变,建立平衡过程中气体分子总物质的量始终不变,混合气体平均相对分子质量始终不变,混合气体平均相对分子质量不变不能说明反应已达到平衡状态;能说明反应已达到平衡状态的是ac,答案选ac。
(3)①反应2NO(g)+2CO(g)![]() N2(g)+2CO2(g)的ΔH=-746.5kJ/mol
N2(g)+2CO2(g)的ΔH=-746.5kJ/mol![]() 0、ΔS
0、ΔS![]() 0,该反应能自发进行时ΔG=ΔH-TΔS
0,该反应能自发进行时ΔG=ΔH-TΔS![]() 0,可见该反应自发进行的条件为低温。
0,可见该反应自发进行的条件为低温。
②根据图像6~9min内,υ(CO)=![]() =0.0067mol/(L·min)。
=0.0067mol/(L·min)。
③根据图像,第12min时改变条件,达到新平衡时N2浓度减小,NO、CO的浓度增大,改变条件平衡向逆反应方向移动,由于该反应的正反应为放热反应,所以改变的条件为升高温度。
④根据图像,结合三段式
2NO(g)+2CO(g)![]() N2(g)+2CO2(g)
N2(g)+2CO2(g)
c(起始)(mol/L) 0.2 0.1 0 0
c(转化)(mol/L) 0.02 0.02 0.01 0.02
c(24min)(mol/L) 0.18 0.08 0.01 0.02
24min时反应达到平衡状态,反应的平衡常数K=![]() =
=![]() =0.01929。若保持温度不变,再向容器中充入CO、N2各0.060mol,此时NO、CO、N2、CO2物质的量浓度依次为0.18mol/L、0.14mol/L、0.07mol/L、0.02mol/L,此时的浓度商Qc=
=0.01929。若保持温度不变,再向容器中充入CO、N2各0.060mol,此时NO、CO、N2、CO2物质的量浓度依次为0.18mol/L、0.14mol/L、0.07mol/L、0.02mol/L,此时的浓度商Qc=![]() =0.044
=0.044![]() 0.01929,平衡将逆向移动。
0.01929,平衡将逆向移动。