题目内容
【题目】按要求回答问题:
(1)氢气燃烧生成液态水的热化学方程式是2H2(g)+O2(g)=2H2O(1),生成2mol液态水放出572kJ的能量,请回答下列问题:
①生成物能量总和___(填“大于”“小于”或“等于”)反应物能量总和。
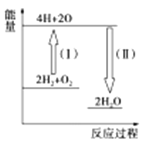
②反应2H2+O2![]() 2H2O的能量变化如图所示。已知拆开1mol H2、1mol O2和1mol H—O中的化学键分别需要消耗436kJ、496kJ和463kJ的能量。则反应过程(Ⅱ)____(填“吸收”或“放出”)___kJ。
2H2O的能量变化如图所示。已知拆开1mol H2、1mol O2和1mol H—O中的化学键分别需要消耗436kJ、496kJ和463kJ的能量。则反应过程(Ⅱ)____(填“吸收”或“放出”)___kJ。
(2)一定温度下,在容积为2L的密闭容器中进行反应:aN(g)![]() bM(g)+cP(g),M、N、P的物质的量随时间变化的曲线如图所示:
bM(g)+cP(g),M、N、P的物质的量随时间变化的曲线如图所示:
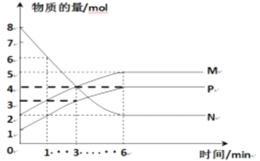
①反应化学方程式中各物质的系数比为a:b:c=____。
②1min到3min这段时刻,以M的浓度变化表示的平均反应速率为:_______。
③下列叙述中能说明上述反应达到平衡状态的是_________。
A 反应中当M与N的物质的量相等时
B P的质量不随时间变化而变化
C 混合气体的总物质的量不随时间变化而变化
D 单位时间内每消耗a mol N,同时消耗b mol M
E 混合气体的压强不随时间的变化而变化
M 的物质的量浓度保持不变
【答案】小于 放出 1852 2:1:1 0.25mol/(L·min) BDF
【解析】
(1)①放热反应,说明反应物的总能量大于生成物的总能量,吸热反应,则相反,△H为负值说明该反应为放热反应;
②反应过程(I)中,能量由低到高,反应吸收热量,反应过程(II)中,能量由高到低,反应放出热量;
(2)①根据物质的量的变化量之比等于化学计量数之比求出方程式化学计量数;
②根据![]() 公式计算M的速率;
公式计算M的速率;
③分析所给条件是否为“变量”来判断反应是否达到平衡。
(1)①由题干信息可知,该反应的△H<0,为放热反应,生成物能量总和小于反应物能量总和,故答案为:小于;
②根据图像,反应过程(Ⅰ)中,能量由低到高,反应吸收热量,反应过程(Ⅱ)中,能量由高到低,反应放出热量,反应过程(Ⅱ)中4molH—O键,放出的热量为:4×463kJ=1852kJ,故答案为:放出;1852;
(2)①由图示信息可知,N、M、P的物质的量在0到6分钟内的变化量为6mol、3mol、3mol,因物质的量的变化量之比等于化学计量数之比,故a:b:c=2:1:1,故答案为:2:1:1;
②1min到3min这段时刻,M的浓度变化量为(4mol-3mol)/2L=0.5mol/L,则速率为0.5mol/L/2min=0.25 mol/(L·min),故答案为:0.25mol/(L·min);
③A. 反应中当M与N的物质的量相等时并不能说明M或N的浓度保持不变,不一定平衡,故A不符合题意;
B.P的质量不随时间变化而变化说明P的浓度保持不变,处于平衡状态,故B符合题意;
C.由于该反应是一个等体积的可逆反应,混合气体的总物质的量不随时间变化而变化不一定平衡,故C不符合题意;
D.单位时间内每消耗a mol N,同时消耗b mol M说明反应的正逆反应速率相等,处于平衡状态,故D符合题意;
E.由于该反应是一个等体积的可逆反应,混合气体的压强不随时间的变化而变化,不一定平衡,故E不符合题意;
F.M的物质的量浓度保持不变说明反应处于平衡状态,故F符合题意;
答案选BDF。

 阅读快车系列答案
阅读快车系列答案【题目】某实验小组为了探究铝与盐酸反应过程中的速率变化,分两组做了以下实验。
(1)甲小组同学用足量的铝与50 mL盐酸发生反应,并用排水集气法收集反应放出的氢气,实验记录如下:
时间/min | 1 | 2 | 3 | 4 | 5 | 反应结束时 |
氢气体积/mL(标准状况下) | 50 | 150 | 300 | 380 | 410 | 560 |
①哪一时间段(即0~1、1~2、2~3、3~4、4~5 min)反应速率最大__,原因是____;
②反应进行到10 min时,便不再有气泡产生,该盐酸中HCl的物质的量浓度是__,整个反应过程中HCl的反应速率为____;
(2)乙小组学生也做了同样的实验,但由于反应太快,不好测量氢气体积,他事先在盐酸中加入等体积的下列液体:A.蒸馏水、B.KCl溶液、C.KNO3溶液、D.CuSO4溶液,以减慢反应速率,你认为可行的是____,不可行的理由是_________。