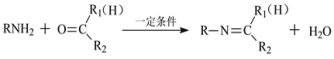��Ŀ����
����Ŀ����ҵ�Ʊ��������Ҫ��Ӧ֮һΪSO2��O2��Ӧ����SO3����ش��������⣺

��1��SO2��O2��Ӧ����SO3�ķ�Ӧ���̵������仯��ͼ1��ʾ����ͼ�����߱仯��֪���÷�ӦΪ___(������������������������Ӧ��
��2��������������ʱ����ͬ�¶���SO2��ת������ʱ��ı仯�����ͼ2��ʾT1___(����>������<����T2��
��3��ij��ʵ���У����ݻ�Ϊ2L�ĺ��º����ܱ�������ͨ��2molSO2��bmolO2����Ӧ�����в������ʵ����ʵ����淴Ӧʱ��ı仯��ͼ3��ʾ��
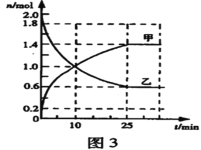
�ټ�Ϊ___(�ѧʽ����ͬ������Ϊ___��
��SO2��O2����SO3�ķ�Ӧ��___��Ӧ��(������������������������
��10minʱ��v��(SO2) _______ v��(SO2)��(����>������<������=����
�ܴӷ�Ӧ��ʼ��ƽ�⣬��Ӧ����v(SO3)=___��
�ݵ�b=___ʱ��O2��SO2��ת������ȡ�
��Ӧ�ﵽƽ��ʱ��SO2��ת����Ϊ___��
���𰸡����� > SO3 SO2 ���� > 0.028molL-1min-1 1 70%
��������
(1)��Ӧ�����������������������������ӦΪ���ȷ�Ӧ��
(2)������������ʱ�������ȹ���ƽ�������ߣ��¶ȸߣ�ѹǿ���з�����
(3)�ٸ���ͼ��������淴Ӧ�Ľ��У������ʵ������ӣ���������ҵ����ʵ������٣��Ƿ�Ӧ�
����ͼ3��֪��25min��SO2��SO3����ɱ��ֲ��䣬�ﵽƽ��״̬����Ӧ�ﲻ��ȫ�������ꣻ
��10minʱ����Ӧ���ҽ��У�v��(SO2)>v��(SO2)��
�ܸ������ʵļ��㹫ʽ���м��㣻
�ݵ�SO2��O2��Ͷ�ϱȵ��ڷ���ʽ�ļ�����ʱ���������ʵ�ת������ȣ�
����ת���ʵļ��㹫ʽ���м��㡣
(1)��ͼ1��ʾ���μӷ�Ӧ��SO2��O2�������������ɵ�SO3����������ӦΪ���ȷ�Ӧ��
�ʴ�Ϊ�����ȣ�
(2)������������ʱ����ͬ�¶���SO2��ת������ʱ��ı仯�����ͼ2��T1��Ӧ���ʿ죬�ȴﵽƽ�⣬��Ӧ�¶ȸߣ�T1>T2��
�ʴ�Ϊ��>��
(3)���淴Ӧ�Ľ��У������ʵ������ӣ����������ΪSO3���ҵ����ʵ������٣��Ƿ�Ӧ���ΪSO2��
�ʴ�Ϊ��SO3��SO2��
����ͼ3��֪��25min��SO2��SO3����ɱ��ֲ��䣬�ﵽƽ��״̬��SO2��O2����SO3�ķ�Ӧ�ǿ��淴Ӧ��
�ʴ�Ϊ�����棻
��10minʱ��SO2�м��ٵ����ƣ��������������ɵ�����v��(SO2)>v��(SO2)��
�ʴ�Ϊ��>��
�ܴӷ�Ӧ��ʼ��ƽ�⣬��Ӧ����v(SO3)=![]() =0.028molL-1min-1��
=0.028molL-1min-1��
�ʴ�Ϊ��0.028molL-1min-1��
�ݵ�SO2��O2��Ͷ�ϱȵ��ڷ���ʽ�ļ�����ʱ���������ʵ�ת������ȣ���2oml:bmol=2:1������b=1ʱ��O2��SO2��ת������ȣ�
�ʴ�Ϊ��1��
��Ӧ�ﵽƽ��ʱ��SO2��ת����Ϊ![]() 70%��
70%��
�ʴ�Ϊ��70%��

 �����ҵ��ٿ���������������ϵ�д�
�����ҵ��ٿ���������������ϵ�д�