题目内容
【题目】向盛有KI溶液的试管中加入少许CCl4后滴加氯水,CCl4层变成紫色。如果继续向试管中滴加氯水,振荡,CCl4层会逐渐变浅,最后变成无色。完成下列填空:
(1)已知碘元素最终变为无色HIO3。上述整个过程中的还原剂是_______________________。写出CCl4层变成紫色的离子反应方程式________________________________________。
(2)若把KI换成KBr,则CCl4层变为_________色,继续滴加氯水,CCl4层的颜色没有变化。Cl2、HIO3、HBrO3氧化性由强到弱的顺序是______________________________________。
(3)智利硝石矿层中含有碘酸钠,可用亚硫酸氢钠与其反应来制备单质碘。试配平该反应的化学方程式,并用短线标出电子转移方向及总数__NaIO3+NaHSO3→NaHSO4+Na2SO4+I2+_H2O,已知含氧酸盐的氧化作用随溶液酸性的加强而增强,在制备试验时,定时取样,并用酸化的氯化钡来检测SO42-离子生成的量,发现开始阶段反应速度呈递增的趋势,试简述这变化趋势发生的原因:________________。
【答案】KI、I2 Cl2+2I-=I2+2Cl- 红棕色或橙红色等 HBrO3>Cl2>HIO3 2 5-3 2 1 1 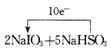 开始阶段,由于HSO3-被氧化生成H+和SO42-,酸性增强,反应速度增大
开始阶段,由于HSO3-被氧化生成H+和SO42-,酸性增强,反应速度增大
【解析】
(1)根据元素的化合价变化判断氧化剂和还原剂;
(2)根据氧化剂的氧化性强于氧化产物的氧化性分析;
(3)根据反应中元素的化合价变化情况结合电子得失守恒和原子守恒分析;根据题干信息分析。
(1)向盛有KI溶液的试管中加入少许CCl4后滴加氯水,CCl4层变成紫色,说明有单质碘生成,碘化钾是还原剂。如果继续向试管中滴加氯水,振荡,CCl4层会逐渐变浅,最后变成无色,已知碘元素最终变为无色HIO3,说明单质碘又被氧化为碘酸,因此上述整个过程中的还原剂是KI、I2。其中CCl4层变成紫色的离子反应方程式为Cl2+2I-=I2+2Cl-。
(2)若把KI换成KBr,溴化钾被氧化为单质溴,单质溴易溶在有机溶剂中,则CCl4层变为红棕色。继续滴加氯水,CCl4层的颜色没有变化,这说明氯气不能氧化单质溴,根据氧化剂和还原剂反应生成还原产物和氧化产物以及氧化剂的氧化性强于氧化产物的氧化性可知Cl2、HIO3、HBrO3氧化性由强到弱的顺序是HBrO3>Cl2>HIO3。
(3)根据方程式可知I元素化合价从+5价降低到0价,失去5个电子,S元素化合价从+4价价升高到+6价,根据电子得失守恒可知转移电子是10个,则其反应的方程式为2NaIO3+5NaHSO3=3NaHSO4+2Na2SO4+I2+H2O,用单线桥表示其电子转移方向及总数为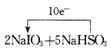 。开始阶段,由于HSO3-被氧化生成H+和SO42-,酸性增强,又因为含氧酸盐的氧化作用随溶液酸性的增强而增强,因此反应速度增大。
。开始阶段,由于HSO3-被氧化生成H+和SO42-,酸性增强,又因为含氧酸盐的氧化作用随溶液酸性的增强而增强,因此反应速度增大。

 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案【题目】在2L密闭容器中,800℃时反应2NO(g)+O2(g)![]() 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)(mol) | 0.01 | 0.005 | 0.004 | 0.0035 | 0.0035 | 0.0035 |
(1)化学平衡常数K=________________________,K值越大,表示____________,已知:该反应K(300℃)>K(350℃),判断该反应是_____________________,(答“放热反应”或“吸热反应”)。
(2)利用表中数据,用NO表示从0~2s内该反应的平均速率v=___________________。
(3)当反应达到平衡后的t2时刻,将混合气体通过“分子筛”,可以及时将产物NO2分离出平衡体系,该操作对__________(填“正反应”或者“逆反应”)的反应速率影响大,请根据平衡移动原理,在下图中画出t2时刻后平衡移动的示意图:______。