题目内容
【题目】亚硝酸钠是重要的防腐剂,某化学兴趣小组以铜和稀硝酸为起始原料,设计如下装置利用NO与Na2O2反应制备NaNO2。(夹持装置已略)

(1)A中反应的化学方程式为_____。
(2)B装置的作用是_____,装置D的作用是_____。
(3)为防止生成其他杂质,B、C装置间还应接入装有_____(填试剂名称)的_____(填仪器名称)。
(4)测定C装置中NaNO2的质量分数的过程如下:准确称取装置C中反应后的固体0.600 g于锥形瓶中,先加水溶解,再向其中滴加0.1000 mol·L-1酸性KMnO4溶液,恰好完全反应时,消耗酸性KMnO4溶液24.00 mL。计算装置C中所得固体中NaNO2的质量分数___________(请写出计算过程)。已知测定过程中发生反应的方程式为MnO4-+NO2-+H+—Mn2++NO3-+H2O(未配平)
【答案】3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O 除去NO中可能混有的NO2 除去未反应掉的NO,防止污染空气 浓硫酸(碱石灰) 洗气瓶(干燥管) n(KMnO4)=24.00 mL×0.1000 mol·L-1×10-3 L·mL-1=2.4×10-3 mol,根据得失电子守恒或关系式n(KMnO4) ×5=n(NO2-)×2 ,n(NO2-)=0.006 mol,NaNO2的质量分数为0.006×69÷0. 600×100%=69.00%
【解析】
⑴A中反应的反应主要是稀硝酸与铜反应,其化学方程式为3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,故答案为3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O;
⑵A中主要产生NO气体,由于里面含有空气,会生成二氧化氮,因此B主要是将A中的二氧化氮变为NO,所以B装置的作用是除去NO中可能混有的NO2,装置C中NO和过氧化钠反应,但NO未反应完,会污染空气,因此D主要是除掉未反应完的NO,所以D的作用是除去未反应掉的NO,防止污染空气,故答案为除去NO中可能混有的NO2;除去未反应掉的NO,防止污染空气;
⑶由于在通入水的过程中有水蒸气带出,水会与过氧化钠反应,为防止生成其他杂质,B、C装置间还应接入装有省油浓硫酸的洗气瓶或者是装有碱石灰的干燥管,故答案为浓硫酸(碱石灰);洗气瓶(干燥管);
⑷消耗酸性KMnO4溶液24.00 mL,0.1000 mol·L-1,因此物质的量为![]()
配平方程式得到:
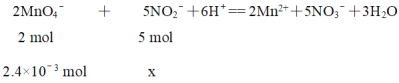
![]()
x = 6×10-3 mol
因此NaNO2的质量分数为![]() ,
,
故答案
消耗酸性KMnO4溶液24.00 mL,0.1000 mol·L-1,因此物质的量为![]()
配平方程式得到:
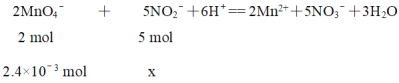
![]()
x = 6×10-3 mol
因此NaNO2的质量分数为![]() 。
。

 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案