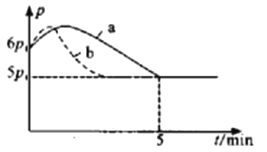
题目内容
【题目】人体含氧65%、碳18%、氢10%、氮3%、钙1.5%、磷1%、钾0.35%、硫0.25%、钠0.15%、氯0.15%、镁0.05%,它们被称为人体常量元素。
(1)人体的构成元素,从周期表来看,元素数目最多族为___________ 族。属于第三周期的非金属元素的原子半径由大到小的顺序______________。人体还有许多微量元素,请列举其中的一种____________。
(2)含量最高的元素原子核外运动状态有___________种,最外层电子轨道表示式_____________;与它同族的另一种元素的活动性相比_______>_______。(用元素符号表示),请用一个事实说明该结论______。
(3)含量前3位的元素按原子个数比1:1:2形成的物质的名称是_____________(写出一种即可)。
【答案】IA p>S>Cl 碘(人体必需微量元素,也有多种包括碘、锌、硒、铜、钼、铬、钴及铁,写出其中的一种即可) 8 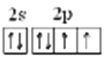 O S 2H2S + O2= 2H2O +2S 乙酸 (其它合理均给分)
O S 2H2S + O2= 2H2O +2S 乙酸 (其它合理均给分)
【解析】
(1)元素数目最多的是H元素;根据元素周期表的结构和元素周期律分析;
(2)含量最高的元素是氧元素;
(3)含量前3位的元素为O、C、H。
(1)根据人体中元素的含量可知O:0.65/10、C:0.18/12、H:0.1/1,所以人体的构成元素中元素数目最多的为氢元素,氢元素位于第ⅠA族。属于第三周期的非金属元素有P、S、Cl,同周期自左向右原子半径逐渐减小,则原子半径由大到小的顺序为p>S>Cl。人体还有许多微量元素,例如碘、锌、硒、铜、钼、铬、钴及铁等。
(2)含量最高的元素是氧元素,氧元素的核外电子数是8个,则原子核外运动状态有8种,最外层电子轨道表示式为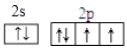 ;同主族元素从上到下非金属性逐渐减弱,则非金属性O>S,元素的非金属性越强,对应单质的氧化性越强,根据反应2H2S+O2=2H2O+2S可以说明氧元素非金属性强于硫元素。
;同主族元素从上到下非金属性逐渐减弱,则非金属性O>S,元素的非金属性越强,对应单质的氧化性越强,根据反应2H2S+O2=2H2O+2S可以说明氧元素非金属性强于硫元素。
(3)含量前3位的元素为O、C、H,它们按原子个数比1:1:2形成的物质有乙酸等。

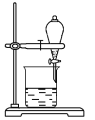
【题目】Ⅰ(1)用CCl4萃取碘水中的碘,下图的分液漏斗中,下层液体呈______色;打开分液漏斗活塞,却未见液体流下,原因可能是_____。
Ⅱ 某同学用某种粗盐进行提纯实验,步骤见下图。
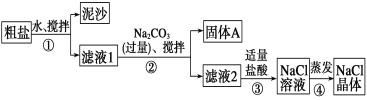
请回答下列问题:
(1)步骤①和②的操作名称是________。
(2)步骤③判断加入盐酸“适量”的方法是______________;步骤④加热蒸发时要用玻璃棒不断搅拌,这是为了____________,当蒸发皿中有较多量固体出现时,应停止加热,用余热使水分蒸干。
(3)猜想和验证:
猜想 | 验证的方法 | 现象 | 结论 |
猜想Ⅰ:固体A中含CaCO3、MgCO3 | 取少量固体A于试管中,滴加稀盐酸,并用涂有澄清石灰水的小烧杯罩于试管口 | _______ | 猜想Ⅰ成立 |
猜想Ⅱ:固体A中含BaCO3 | 取少量固体A于试管中,先滴入________,再滴入Na2SO4溶液 | 有气泡放出,无白色沉淀 | _____ |
猜想Ⅲ:最后制得的NaCl晶体中还含有Na2SO4 | 取少量NaCl晶体溶于试管中的蒸馏水,________ | _______ | 猜想Ⅲ成立 |