题目内容
【题目】在2L密闭容器中,800℃时反应2NO(g)+O2(g)![]() 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)(mol) | 0.01 | 0.005 | 0.004 | 0.0035 | 0.0035 | 0.0035 |
(1)化学平衡常数K=________________________,K值越大,表示____________,已知:该反应K(300℃)>K(350℃),判断该反应是_____________________,(答“放热反应”或“吸热反应”)。
(2)利用表中数据,用NO表示从0~2s内该反应的平均速率v=___________________。
(3)当反应达到平衡后的t2时刻,将混合气体通过“分子筛”,可以及时将产物NO2分离出平衡体系,该操作对__________(填“正反应”或者“逆反应”)的反应速率影响大,请根据平衡移动原理,在下图中画出t2时刻后平衡移动的示意图:______。

【答案】c2(NO2)/c2(NO2)·c(O2) 反应进行得越完全(其它合理答案也可) 放热反应 0.0015 mol·L-1·s-1 逆反应 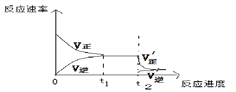
【解析】
(1)根据平衡常数的含义判断;根据温度对平衡常数的影响判断;
(2)根据反应速率的含义结合表中数据计算;
(3)根据浓度对反应速率和平衡状态的影响分析解答。
(1)化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,则反应2NO(g)+O2(g)![]() 2NO2(g)的平衡常数表达式为K=c2(NO2)/c2(NO2)·c(O2)。K值越大,表示反应进行得越完全;已知:该反应K(300℃)>K(350℃),这说明升高温度平衡常数减小,即反应向逆反应方向进行,所以判断该反应为放热反应。
2NO2(g)的平衡常数表达式为K=c2(NO2)/c2(NO2)·c(O2)。K值越大,表示反应进行得越完全;已知:该反应K(300℃)>K(350℃),这说明升高温度平衡常数减小,即反应向逆反应方向进行,所以判断该反应为放热反应。
(2)利用表中数据可知从0~2s内NO的物质的量减少了0.01mol-0.004mol=0.006mol,浓度是0.006mol÷2L=0.003mol/L,则根据v=△c÷△t可知用NO表示从0~2s内该反应的平均速率v=0.003mol/L÷2s=0.0015 mol·L-1·s-1。
(3)当反应达到平衡后的t2时刻,将混合气体通过“分子筛”,可以及时将产物NO2分离出平衡体系,生成物浓度降低,则该操作对逆反应的反应速率影响大,生成物浓度降低,逆反应速率减小,正反应速率不变,则平衡向正反应方向进行,因此t2时刻后平衡移动的示意图为 。
。

 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案