题目内容
5. 把镁条投入到盛有稀硫酸的敞口容器中,产生H2的速率如图所示,在下列因素中,①H+的浓度 ②镁条的表面积 ③溶液的温度 ④SO42-的浓度,影响反应速率的因素是( )
把镁条投入到盛有稀硫酸的敞口容器中,产生H2的速率如图所示,在下列因素中,①H+的浓度 ②镁条的表面积 ③溶液的温度 ④SO42-的浓度,影响反应速率的因素是( )| A. | ①④ | B. | ①②③ | C. | ②③ | D. | ③④ |
分析 由图可知,生成氢气的反应速率先增大后减小,利用反应实质Mg+2H+═Mg2++H2↑是放热反应及影响反应速率的因素来分析.
解答 解:因图中生成氢气的反应速率先增大后减小,发生的反应为Mg+2H+═Mg2++H2↑,
①开始盐酸的浓度较大,反应速率加快,但随反应的进行,浓度减小,则反应速率减小,故①正确;
②由反应可知Mg参加反应,开始接触面积大,反应速率快,但随反应的进行,接触面积减小,则反应速率减小,故②正确;
③因该反应为放热反应,放热使温度升高,则反应速率加快,但随反应的进行,容易温度升高不明显,氢离子浓度降低,反应速率减慢,故③正确;
④因SO42-不参加反应,SO42-的浓度增大或减小都不影响化学反应速率,且该反应中SO42-的浓度不变,故④错误;
即影响反应速率的因素为①②③,故选B.
点评 本题考查影响化学反应速率的因素,学生明确图象中的反应速率变化及影响反应速率的常见因素是解答本题的关键.

练习册系列答案
相关题目
15.用NA表示阿伏伽德罗常数的值.下列判断正确的是( )
| A. | 28g N2含有的氮原子数目为NA | |
| B. | 常温常压下,22.4L Cl2含有的分子数目为NA | |
| C. | 1molNa变为Na+时失去的电子数目为NA | |
| D. | 1L 1mol•L-1K2CO3溶液中含有的钾离子数目为NA |
13.Ⅰ.在实验室利用下列装置,可制备某些气体并验证其化学性质.
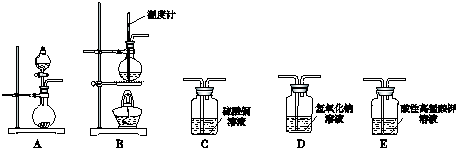
完成下列表格:
(3)D装置中氢氧化钠溶液的作用除二氧化碳和二氧化硫
Ⅱ.工业上用乙烯和氯气为原料,经下列各步合成聚氯乙烯(PVC):
乙烯$→_{(1)}^{一定条件}$甲$→_{(2)}^{一定条件}$乙$→_{(3)}^{一定条件}$PVC
甲的结构简式是CH2ClCH2Cl;反应(3)的化学方程式是nH2C=CHCl$\stackrel{催化剂}{→}$ .
.

完成下列表格:
| 序号 | 气体 | 装置连接顺序(填字母) | 制备反应的化学方程式 |
| (1) | 乙烯 | B→D→E | CH3-CH2-OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O |
| (2) | 乙炔 | A→C→E | CaC2+2H2O→CH≡CH↑+Ca(OH)2 |
Ⅱ.工业上用乙烯和氯气为原料,经下列各步合成聚氯乙烯(PVC):
乙烯$→_{(1)}^{一定条件}$甲$→_{(2)}^{一定条件}$乙$→_{(3)}^{一定条件}$PVC
甲的结构简式是CH2ClCH2Cl;反应(3)的化学方程式是nH2C=CHCl$\stackrel{催化剂}{→}$
 .
.
20.下列说法正确的是( )
| A. | 稀有气体元素最外层电子数均为8个 | |
| B. | 原子最外层少于4个电子的元素均是金属元素 | |
| C. | 相同条件下,H2O的沸点比H2S高是因为水分子间含有氢键 | |
| D. | 目前人们已发现了5000多种核素,说明发现了5000多种元素 |
17.已知五种短周期元素的原子半径及主要化合价如下表:
下列叙述正确的是( )
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.104 | 0.111 | 0.066 |
| 主要化合价 | +2 | +3 | +6、-2 | +2 | -2 |
| A. | L与T形成的化合物属于共价化合物 | |
| B. | M的最高价氧化物的水化物具有两性 | |
| C. | T、Q的氢化物常温常压下均为无色气体 | |
| D. | L、M的单质与稀盐酸反应速率:M>L |
14.下列说法正确的是( )??
| A. | 苯不能使酸性KMnO4溶液褪色,与甲烷性质相似,因此苯为饱和烃 | |
| B. | 苯的结构简式为 ,有三个双键,可与溴水发生加成反应 ,有三个双键,可与溴水发生加成反应 | |
| C. | 苯的6个碳原子和6个氢原子在同一平面内 | |
| D. | 将1mL苯和1mL水充分混合后静置,二者互溶 |
15.已知N2(g)+3H2(g)?2NH3(g),现向一密闭容器中充入1molN2和3molH2,在高温、高压和催化剂存在条件下发生反应. 下列有关说法正确的是( )
| A. | 最终可以生成2 mol NH 3 | |
| B. | 单位时间内,若消耗了0.5mol N2的同时,生成1 mol NH3,则反应达到平衡 | |
| C. | 反应达到化学平衡状态时,容器中N2、H2和NH3的物质的量之比为1:3:2 | |
| D. | 反应达到化学平衡状态时,N2、H2和NH3的物质的量浓度不再变化 |
 图为一个原电池,完成下列问题:
图为一个原电池,完成下列问题: