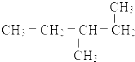题目内容
15.已知N2(g)+3H2(g)?2NH3(g),现向一密闭容器中充入1molN2和3molH2,在高温、高压和催化剂存在条件下发生反应. 下列有关说法正确的是( )| A. | 最终可以生成2 mol NH 3 | |
| B. | 单位时间内,若消耗了0.5mol N2的同时,生成1 mol NH3,则反应达到平衡 | |
| C. | 反应达到化学平衡状态时,容器中N2、H2和NH3的物质的量之比为1:3:2 | |
| D. | 反应达到化学平衡状态时,N2、H2和NH3的物质的量浓度不再变化 |
分析 可逆反应不能进行彻底,当达到化学平衡状态时,正逆反应速率相等,各物质的浓度不再改变,由此衍生的一些物理量也不再发生变化,注意反应方程式的前后计量数关系,据此分析.
解答 解:A.反应为可逆反应,反应物不能完全转化,故A错误;
B.消耗了0.5mol N2的同时,生成1 mol NH3,是指反应正向进行的过程,不能说明反应达到化学平衡状态时,故B错误;
C.反应的外界条件不确定,反应物的转化率不确定,则不能确定平衡时各物质的物质的量关系,故C错误;
D.当达到化学平衡状态时,各物质的浓度不再改变,故D正确.
故选D.
点评 本题考查化学平衡状态的判断,题目难度不大,注意把握化学平衡状态的特征以及可逆反应的特征.

练习册系列答案
 发散思维新课堂系列答案
发散思维新课堂系列答案
相关题目
5. 把镁条投入到盛有稀硫酸的敞口容器中,产生H2的速率如图所示,在下列因素中,①H+的浓度 ②镁条的表面积 ③溶液的温度 ④SO42-的浓度,影响反应速率的因素是( )
把镁条投入到盛有稀硫酸的敞口容器中,产生H2的速率如图所示,在下列因素中,①H+的浓度 ②镁条的表面积 ③溶液的温度 ④SO42-的浓度,影响反应速率的因素是( )
 把镁条投入到盛有稀硫酸的敞口容器中,产生H2的速率如图所示,在下列因素中,①H+的浓度 ②镁条的表面积 ③溶液的温度 ④SO42-的浓度,影响反应速率的因素是( )
把镁条投入到盛有稀硫酸的敞口容器中,产生H2的速率如图所示,在下列因素中,①H+的浓度 ②镁条的表面积 ③溶液的温度 ④SO42-的浓度,影响反应速率的因素是( )| A. | ①④ | B. | ①②③ | C. | ②③ | D. | ③④ |
6.一定条件下,可逆反应2X(g)+3Y(g)?4Z(g),若X、Y、Z起始浓度分别为c1、c2、c3(均不为0),平衡时X、Y、Z的浓度分别为0.2mol•L-1、0.3mol•L-1、0.16mol•L-1,则下列判断不合理的是( )
| A. | 平衡时,Y和Z的生成速率之比为3:4 | |
| B. | c1的取值范围为0<c1<0.28 mol•L-1 | |
| C. | 当反应达到平衡时,扩大容器的体积,平衡会发生移动 | |
| D. | 此反应,若起始通入2 mol•L-1的X和3 mol•L-1的Y达到平衡时,与起始只通入4 mol•L-1的Z达到平衡时,各物质的组成含量不相同 |
10.石墨和金刚石都是碳的单质,石墨在一定条件下可转化为金刚石.已知把石墨完全转化为金刚石时,要吸收能量,下列说法正确的是( )
| A. | 等质量的金刚石与石墨完全燃烧,放出的能量一样多 | |
| B. | 等质量的金刚石与石墨完全燃烧,石墨放出的能量少 | |
| C. | 石墨不如金刚石稳定 | |
| D. | 金刚石不如石墨稳定 |
1.常温常压下,向2L密闭容器中加入一定量的A和B气体,发生反应2A(g)+2B(g)?2Q(g)+W(g),△H=M kJ•mol-1,3min后,反应达到平衡,相关数据如下表:则下列说法正确的是( )
| 反应时间/min | n(A)/mol | n(B)/mol |
| 0 | 4 | 4 |
| 0.5 | 3.2 | |
| 2 | 2.4 | |
| 3 | 1.0 |
| A. | 反应在前0.5min时,n(W)=0.6mol | |
| B. | 2min时,反应的平均反应速率为V(Q)=0.48mol/L•s | |
| C. | 相同温度条件下,向平衡后的容器中再充入2mol Q和2mol W时,v(正)>v(逆) | |
| D. | 相同温度下,平衡时的平衡常数为27L•mol-1 |

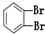 ⑨235U ⑩
⑨235U ⑩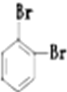
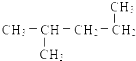 ⑫
⑫