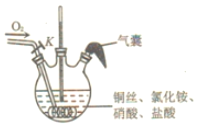
题目内容
【题目】亚硝酰氯![]() 是有机物合成中的重要试剂,其沸点为
是有机物合成中的重要试剂,其沸点为![]() ,易水解。已知:
,易水解。已知:![]() 微溶于水,能溶于硝酸,
微溶于水,能溶于硝酸,![]() ,某学习小组在实验室用
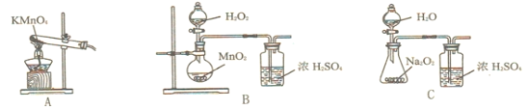
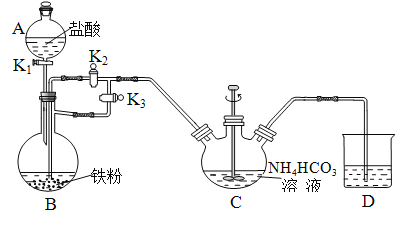
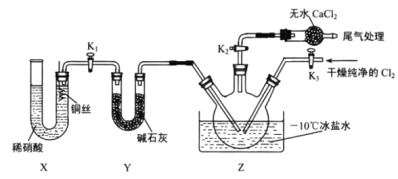
,某学习小组在实验室用![]() 和NO制备ClNO并测定其纯度,相关实验装置如图所示。
和NO制备ClNO并测定其纯度,相关实验装置如图所示。
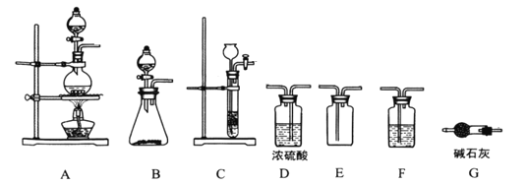
⑴制备![]() 的发生装置可以选用_______(填字母代号)装置,发生反应的离子方程式为___________。
的发生装置可以选用_______(填字母代号)装置,发生反应的离子方程式为___________。
⑵欲收集一瓶干燥的氯气,选择合适的装置,其连接顺序为![]() ________________(填字母代号)。
________________(填字母代号)。
⑶实验室可用图示装置制备亚硝酰氯,检验装置气密性并装入药品,打开![]() ,然后再打开
,然后再打开![]() ,通入一段时间气体,其目的是____________,然后进行其他操作,当Z中有一定量液体生成时,停止实验。
,通入一段时间气体,其目的是____________,然后进行其他操作,当Z中有一定量液体生成时,停止实验。
⑷已知:ClNO水解生成![]() 写出化学反应方程式__________________。
写出化学反应方程式__________________。
①欲设计实验证明![]() 是弱酸,需选择如下_____________试剂开展实验
是弱酸,需选择如下_____________试剂开展实验![]() 填选项
填选项![]() 。
。
A. ![]() 溶液 B.
溶液 B. ![]() 溶液 C. 红色石蕊试纸 D. 蓝色石蕊试纸
溶液 C. 红色石蕊试纸 D. 蓝色石蕊试纸
![]() 已知下列物质在常温下的
已知下列物质在常温下的![]() 如图:
如图:
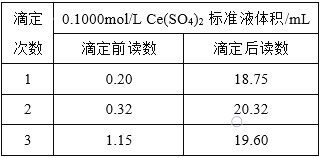
通过以下实验测定ClNO样品的纯度。取Z中所得液体![]() 溶于水,配制成
溶于水,配制成![]() 溶液;取出
溶液;取出![]() 样品溶于锥形瓶中,用
样品溶于锥形瓶中,用![]() 标准溶液滴定至终点,应加入的指示剂是_______________。
标准溶液滴定至终点,应加入的指示剂是_______________。
A.![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
消耗标准溶液的体积为![]() ,滴定终点的现象是 ________________,亚硝酰氯
,滴定终点的现象是 ________________,亚硝酰氯![]() 的质量分数为________。
的质量分数为________。
【答案】A(或B) ![]() 或
或![]()
![]() 排干净三颈烧瓶中的空气
排干净三颈烧瓶中的空气 ![]() BC D 滴入最后一滴标准液,生成砖红色沉淀,且半分钟内无变化
BC D 滴入最后一滴标准液,生成砖红色沉淀,且半分钟内无变化 ![]()
【解析】
⑴实验室制备氯气可用二氧化锰与浓盐酸加热反应生成氯气,满足固、液加热制备气体的条件,因此A装置符合;或用高锰酸钾与浓盐酸反应生成氯气。
⑵氯气中含有氯化氢和水蒸气,要通过饱和食盐水装置,吸收氯化氢,通过浓硫酸装置,吸收水蒸气,得到干燥的氯气,用向上排空气法收集,尾气用碱石灰吸收。
⑶通入一段时间氯气,排尽三颈烧瓶中的空气,防止NO和ClNO变质。
⑷![]() 与
与![]() 反应生成
反应生成![]() 和HCl,得到化学反应方程式。
和HCl,得到化学反应方程式。
①证明![]() 是弱酸可利用其对应强碱盐溶液呈碱性来进行。
是弱酸可利用其对应强碱盐溶液呈碱性来进行。
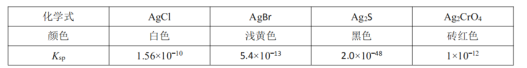
②氯离子沉淀完全时,![]() 可知,需要
可知,需要![]() 的浓度最大,且
的浓度最大,且![]() 的颜色易于观察到,以
的颜色易于观察到,以![]() 溶液为指示剂,根据
溶液为指示剂,根据![]() 进行计算。
进行计算。
⑴实验室制备氯气可用二氧化锰与浓盐酸加热反应生成氯气,满足固、液加热制备气体的条件,因此A装置符合;或用高锰酸钾与浓盐酸反应生成氯气,符合固、液不加热反应制备气体的条件,因此B装置符合,反应的离子方程式:![]() 或者
或者![]() ;故答案为:A(或者B)
;故答案为:A(或者B)![]() 或者
或者![]() 。
。
⑵氯气中含有氯化氢和水蒸气,要通过饱和食盐水装置,吸收氯化氢,通过浓硫酸装置,吸收水蒸气,得到干燥的氯气,用向上排空气法收集,尾气用碱石灰吸收;所以装置的连接顺序为![]() ;故答案为:
;故答案为:![]() 。
。
⑶通入一段时间氯气,排尽三颈烧瓶中的空气,防止NO和ClNO变质;故答案为:排干净三颈烧瓶中的空气。
⑷![]() 与
与![]() 反应生成
反应生成![]() 和HCl,化学反应方程式为
和HCl,化学反应方程式为![]() ;故答案为:
;故答案为:![]() 。
。
①证明![]() 是弱酸可利用其对应强碱盐溶液呈碱性来进行:用玻璃棒蘸取
是弱酸可利用其对应强碱盐溶液呈碱性来进行:用玻璃棒蘸取![]() 溶液,点在红色石蕊试纸中央,若试纸变蓝,说明
溶液,点在红色石蕊试纸中央,若试纸变蓝,说明![]() 是弱酸,故需选择B.
是弱酸,故需选择B. ![]() 溶液C. 红色石蕊试纸试剂开展实验;故答案为:BC。
溶液C. 红色石蕊试纸试剂开展实验;故答案为:BC。
②氯离子沉淀完全时,![]() 可知,需要
可知,需要![]() 的浓度最大,且
的浓度最大,且![]() 的颜色易于观察到,以
的颜色易于观察到,以![]() 溶液为指示剂,用
溶液为指示剂,用![]() 标准溶液滴定至终点,滴定终点的现象是滴入最后一滴标准溶液,生成砖红色沉淀,且半分钟内无变化;由
标准溶液滴定至终点,滴定终点的现象是滴入最后一滴标准溶液,生成砖红色沉淀,且半分钟内无变化;由![]() ,
,![]() 可知,ClNO与水反应后生成盐酸,
可知,ClNO与水反应后生成盐酸,![]() 先与溶液中
先与溶液中![]() 反应生成氯化银沉淀,然后
反应生成氯化银沉淀,然后![]() 与溶液中指示剂
与溶液中指示剂![]() 反应生成砖红色沉淀,这时表示达到滴定终点,氯离子反应完全,根据
反应生成砖红色沉淀,这时表示达到滴定终点,氯离子反应完全,根据![]() 与
与![]() 的反应关系可知:
的反应关系可知:![]() ,亚硝酰氯
,亚硝酰氯![]() 的质量分数为
的质量分数为![]() ;故答案为:D;滴入最后一滴标准液,生成砖红色沉淀,且半分钟内无变化;
;故答案为:D;滴入最后一滴标准液,生成砖红色沉淀,且半分钟内无变化;![]() 。
。