题目内容
【题目】300 ℃时,将2 mol SO2、1 mol O2混合于2 L的恒容密闭容器中,发生反应2SO2(g) + O2(g) ![]() 2SO3(g) ΔH,2 min末达到平衡,测得SO2的转化率为60%。请根据化学反应的有关原理回答下列问题:
2SO3(g) ΔH,2 min末达到平衡,测得SO2的转化率为60%。请根据化学反应的有关原理回答下列问题:
(1)能证明反应已经达到平衡状态的是________。
① c(SO2)∶c(O2)∶c(SO3) = 2∶1∶2
②单位时间内生成n mol SO3的同时消耗n mol SO2
③反应速率v(SO3) = 2v(O2)
④温度和体积一定时,容器内压强不再变化
⑤温度和压强一定时,混合气体的密度不再变化
(2)下图表示该反应的速率(v)随时间(t)变化的关系:
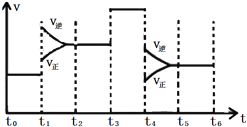
据图分析;t3时改变的外界条件可能是________;t6时保持体积不变向体系中充入少量He,平衡________(填“向左”“向右”或“不”)移动。SO2含量最高的区间是______(填“t0~t1”、“t2~t3”、“t3~t4”或“t5~t6”)。
(3)300 ℃时,该反应的平衡常数为________,若升高温度该反应的平衡常数减小,则ΔH___0(填“大于”、“小于”或“不确定”)。
(4)如果在相同条件下,上述反应从逆反应方向开始进行,开始时加入SO2 0.6 mol、SO3 1.4 mol,若使平衡时各物质的量浓度与原来平衡相同,则还应加入O2________mol。
【答案】 ④⑤ 加催化剂 不 t5~t6 11.25 小于 0.3
【解析】试题分析:(1)①c(SO2):c(O2):c(SO3)=2:1:2并不能说明正逆反应速率相等,因此不一定达到平衡状态,①错误;②单位时间内生成nmol SO3的同时消耗nmol SO2,均表示正反应速率,因此不一定达到平衡状态,②错误;③反应速率2v(SO3)=v(O2)没有表明反应速率方向,因此不一定达到平衡状态,③错误;④正反应是体积减小的,所以温度和体积一定时,容器内压强不再变化可说明反应达到平衡状态,④正确;⑤密度是混合气体的质量和容器容积的比值,反应前后质量不变,温度和压强一定时,容器容积是变化的,因此混合气体的密度不再变化能说明反应达到平衡状态,⑤正确,答案选④⑤;
(2)t3时正逆反应速率均增大,且增大程度相同,平衡不移动。由于正反应是体积减小的,所以改变的外界条件可能是使用了催化剂。t6时保持体积不变向体系中充入少量He气,各物质的浓度不变,平衡不移动。根据图像可知平衡一直向逆反应方向进行,所以SO2%含量最高的区间是t5~t6。
(3) 2SO2(g)+O2(g)![]() 2SO3(g)
2SO3(g)
起始浓度(mol/L) 1 0.5 0
转化浓度(mol/L) 0.6 0.3 0.6
平衡浓度(mol/L) 0.4 0.2 0.6
所以300℃时,该反应的平衡常数为![]() 。若升高温度该反应的平衡常数减小,这说明平衡向逆反应方向进行,所以正反应是放热反应,则ΔH小于0。
。若升高温度该反应的平衡常数减小,这说明平衡向逆反应方向进行,所以正反应是放热反应,则ΔH小于0。
(4)如果在相同条件下,上述反应从逆反应方向进行,开始时加入SO20.6 mol加入SO31.4 mol,若使平衡时各物质的量浓度与原来平衡相同,则完全转化后应该是2mol二氧化硫和1mol氧气。1.4mol三氧化硫完全转化后生成1.4mol二氧化硫和0.7mol氧气,还应加入O21mol-0.7mol=0.3mol。

 名校课堂系列答案
名校课堂系列答案【题目】下列各组物质中,X表示某物,Y表示X物质中含有的少量杂,Z表示要除去杂质加入的试剂,其中正确的组别是( )
X | Y | Z | |
A | FeCl2 溶液 | FeCl3 | KSCN 溶液 |
B | H2 | SO2 | NaOH 溶液 |
C | Fe2(SO4)3溶液 | FeSO4 | Cl2 |
D | SiO2 | Fe2O3 | NaOH 溶液 |
A.A
B.B
C.C
D.D