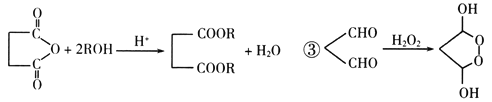题目内容
【题目】已知NaHSO3溶液呈酸性,NaHCO3溶液呈碱性。对于浓度均为0.1 mol·L1的NaHSO3溶液和NaHCO3溶液,溶液中各微粒的物质的量浓度关系正确的是(R表示S或C) ( )
A. 两溶液中均有c(Na+) > c(![]() ) > c(H+) > c(
) > c(H+) > c(![]() ) > c(OH)
) > c(OH)
B. 两溶液中均有c(Na+) + c(H+) = c(![]() ) + c(
) + c(![]() ) + c(OH)
) + c(OH)
C. 两溶液中均有c(H+) + c(H2RO3) = c(![]() ) + c(OH)
) + c(OH)
D. 两溶液中c(Na+)、c(![]() )、c(
)、c(![]() )分别对应相等
)分别对应相等
【答案】C
【解析】在NaHSO3溶液中,HSO3-的电离方程式为HSO3-H++SO32-,水解方程式为HSO3-+H2OH2SO3+OH-,因其电离程度大于水解程度,所以溶液呈酸性;HCO3-和HSO3-相似,既能电离又能水解,因其电离程度小于水解程度,所以NaHCO3溶液呈碱性。由此分析如下:在A的关系式中,体现两溶液都显酸性是错误的,即A错误;B是电荷守恒,但c(RO32-)没有加系数2,所以B错误;C、这两种溶液中,都有电荷守恒c(Na+)+ c(H+) = c(HRO3-)+ 2c(RO32-) +c(OH),和物料守恒c(Na+)=c(HRO3-)+c(RO32-)+c(H2RO3),二式联立即得 c(H+)+ c(H2RO3) = (RO32-) +c(OH),所以C正确;D、因为二者的水解程度和电离程度不同,所以这三种离子浓度不会对应相等的,所以D错误。本题正确答案为C。

【题目】资料表明:赤热铜能与NO2反应。某小组设计了如下实验装置进行探究,探究固体产物的成分,气体产物是N2还是NO。
已知:酸性KMnO4溶液能氧化NO生成NO3ˉ;
NO和FeSO4溶液反应:NO+FeSO4=[Fe(NO)]SO4(棕色);
Cu2O+2H+=Cu+Cu2++H2O

请回答下列问题:
(1)A中反应的化学方程式为________________________。
(2)检查装置气密性,装好药品,然后实验的正确操作顺序是____________
①关闭K1,打开K2 ②打开分液漏斗活塞
③打开K1,关闭K2 ④点燃C处酒精灯
(3)实验过程中,D装置中的现象是____________,能否根据D装置中的现象确认C中有无NO生成? ______,理由是________________________。
(4)E装置的作用是____________。
(5)当铜粉完全反应后,实验小组对反应后的固体成分提出以下猜想:①只有CuO;②只有Cu2O;有同学认为可通过简单的定性实验即可判断猜想①是否成立,其实验方法是_____________________。
(6)实验中E装置自始至终未显棕色,小组最后通过定量实验得到如下数据。
C装置质量 | F装置气体的体积(已折算为标准状况) | ||
玻管质量 | Cu质量 | 反应后(玻管+生成物) | |
mg | 1.92g | (m+2.24)g | 112mL |
据此写出实验时实际发生反应的化学方程式________________________。
【题目】某工厂的电镀污泥中含有铜、铁等金属化合物。为实现资源的回收利用并有效防止环境污染,设计如下工艺流程:

沉淀物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
开始沉淀的pH | 2.3 | 7.6 | 4.4 |
完全沉淀的pH | 3.2 | 9.7 | 6.4 |
(1)酸浸后加入H2O2的目的是________________,调pH的最适宜范围为________________。
(2)调pH过程中加入的试剂最好是___________。
A. NaOH B. CuO C.NH3·H2O D.HCl
(3)煮沸CuSO4溶液的原因是_________。向CuSO4溶液中加入一定量的NaCl、Na2SO3,可以生成白色的CuCl沉淀,写出该反应的化学方程式_________。
(4)过滤后的沉淀表面通常附着有一些杂质离子,为得到纯净产物,需要进行洗涤,确定沉淀洗涤干净的操作及现象是_________。
(5)称取所制备的CuCl样品0.2500g置于一定量的0.5mol·L-1FeCl3溶液中,待样品完全溶解后,加水20mL,用0.1000 mol·L-1的Ce(SO4)2溶液滴定,到达终点时消耗Ce(SO4)2溶液25.00mL。有关的化学反应为Fe3++CuCl=Fe2++Cu2++Cl-,Ce4++Fe2+=Fe3++Ce3+。计算该CuCl样品的质量分数__________。