题目内容
Mg、Al两种金属分别跟同体积、同浓度的稀H2SO4反应,同温同压下生成氢气的体积相同,则Mg、Al两种金属之间的量的关系一定正确的是
| A.两个反应电子转移的数目相等 | B.加入镁、铝质量比为4∶3 |
| C.金属溶解的物质的量相等 | D.加入的两种金属质量不等 |
A
解析试题分析:A、Mg、Al两种金属分别跟同体积、同浓度的稀H2SO4反应,同温同压下生成氢气的体积相同,由于氢元素的化合价均是由+1价降低到0价,所以两个反应电子转移的数目相等,A正确;B、1mol镁在反应中失去2mol电子,1mol铝在反应中失去3个电子。由于两个反应电子转移的数目相等,则参加反应的镁、铝的物质的量之比=3∶2,质量之比=3×24∶2×27=4∶3,但加如的镁和铝的质量之比不能确定,B不正确;C、根据B中分析可知,金属溶解的物质的量之比=3∶2,C不正确;D、根据B中分析可知,无法计算加入的金属质量,D不正确,答案选A。
考点:考查金属镁、铝与稀硫酸反应的有关计算

 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案某固体混合物可能由Al、(NH4)2SO4、MgCl2、FeCl2、AlCl3中的一种或几种组成,现对该混合物做如下实验,所得现象和有关数据如图所示(气体体积数据已换算成标准状况下的体积):
下列说法正确的是
| A.固体混合物中一定含有Al,但质量不可确定 |
| B.固体混合物中可能含有MgCl2和AlCl3 |
| C.固体混合物中一定含有MgCl2和FeCl2 |
| D.固体混合物中一定含有 (NH4)2SO4、MgCl2 |
在FeCl3和CuCl2混合液中,加入一定量的铁粉,充分反应后,溶液中的金属离子不可能是
| A.有Fe2+ | B.Cu2+、Fe2+ 和Fe3+ |
| C.仅有 Fe3+ 和Fe2+ | D.有Cu2+和Fe2+ |
铁和铁合金是生活中常用的材料,下列说法正确的是
| A.一定条件下,铁粉可与水蒸气反应 | B.不锈钢是铁合金,只含金属元素 |
| C.铁与盐酸反应,铁合金不与盐酸反应 | D.在空气中,铁板比镀锌铁板更耐腐蚀 |
把生锈的铁钉放入足量稀盐酸中,可能发生的反应是( )
| A.只有置换反应 | B.只有复分解反应 |
| C.置换和复分解反应 | D.置换和分解反应 |
金属钠长期露置在空气中,最后转变为( )
| A.Na2CO3 | B.Na2O2 | C.NaOH | D.Na2O |
将26g CO和O2的混合气体充入一体积固定不变的密闭容器中(容器内有足量的Na2O2固体),此时容器的压强为p1,用电火花不间断地点燃,使其充分反应,恢复至原温度,结果固体增重14g,此时容器的压强为p2,则p1:p2为
| A.9:4 | B.7:3 | C.7:6 | D.6:7 |
双羟基铝碳酸钠是医疗上常用的一种抑酸剂,化学式是NaAl(OH)2CO3关于该物质的说法正确的是( )
| A.该物质是Al(OH)3和Na2CO3的混合物 |
| B.1 mol NaAl(OH)2CO3最多可消耗4 mol H+ |
| C.该药剂遇胃酸不产生气体,适合胃溃疡患者服用 |
| D.该物质属于两性氢氧化物 |
利用下图装置做铝热反应实验。下列说法不正确的是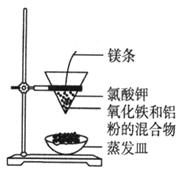
A.该反应的化学方程式是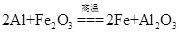 |
| B.该反应会产生高温、发出强光 |
| C.根据铝热反应的原理,可以冶炼某些金属 |
| D.若反应中转移3 mol电子,则消耗氧化剂的物质的量是1 mol |