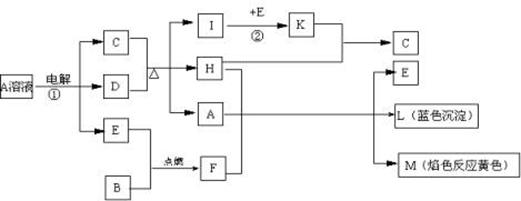
题目内容
(13分)铁及铁的化合物应用广泛,如FeCl3可用作催化剂、印刷电路铜板腐蚀剂和外伤止血剂等。
(1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式: _______________________________
(2)若将(1)中的反应设计成原电池,请在方框内画出原电池的装置图,标出正、负极及材料、电解质溶液并写出电极反应式。 
正极反应____________________________;
负极反应____________________________。
(3)氢氧燃料电池是符合绿色化学理念的新型发电装置。下图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定。请回答下列问题: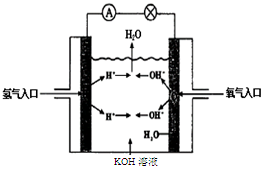
①负极反应式为 溶液PH (填“增大”、“不变”或“减小”)。
②该电池工作时,H2和O2连续由外部供给,电池可连续不断提供电能。因此,大量安全储氢是关键技术之一。金属锂是一种重要的储氢材料,吸氢和放氢原理如下:
Ⅰ.2Li+H2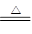 2LiH Ⅱ.LiH+H2O=LiOH+H2↑
2LiH Ⅱ.LiH+H2O=LiOH+H2↑
反应Ⅰ中的还原剂是 ,7 gLi可吸收标况下H2 L,此时转移电子 moL。
(1)2Fe3+ + Cu = 2Fe2+ + Cu2+
(2)2Fe3+ + 2e-= 2Fe2+ ;Cu - 2e-= Cu2+ 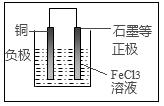
(3)①2H2 - 4e- + 4OH—= 4H2O;减小 ②Li;11.2;1
解析试题分析:(1)FeCl3溶液腐蚀印刷电路铜板的离子方程式是2Fe3+ + Cu = 2Fe2+ + Cu2+(2)若将(1)中的反应设计成原电池,则Cu作负极,活动性比Cu弱的金属或石墨作正极,含有Fe3+离子的溶液作电解质溶液,装置图是 ;正极反应是2Fe3+ + 2e-= 2Fe2+ ;负极反应是Cu - 2e-= Cu2+;(3)①在氢氧燃料电池中,通入燃料的电极是负极,负极反应式为2H2 - 4e- + 4OH—= 4H2O;通入氧气的电极是正极,正极的电极反应式是:O2 + 4e- + 2H2O = 4OH— ;由于不断消耗氢氧根离子,所以溶液的pH逐渐减小;②在反应Ⅰ中的还原剂是Li;7 gLi的物质的量是1mol,根据反应方程式可知反应消耗0.5mol的氢气,其在标况下的体积是11.2L。由于Li是+1价的金属,所以此时转移电子是1mol。
;正极反应是2Fe3+ + 2e-= 2Fe2+ ;负极反应是Cu - 2e-= Cu2+;(3)①在氢氧燃料电池中,通入燃料的电极是负极,负极反应式为2H2 - 4e- + 4OH—= 4H2O;通入氧气的电极是正极,正极的电极反应式是:O2 + 4e- + 2H2O = 4OH— ;由于不断消耗氢氧根离子,所以溶液的pH逐渐减小;②在反应Ⅰ中的还原剂是Li;7 gLi的物质的量是1mol,根据反应方程式可知反应消耗0.5mol的氢气,其在标况下的体积是11.2L。由于Li是+1价的金属,所以此时转移电子是1mol。
考点:考查原电池的反应原理、电极反应式的书写及电子转移的知识。

 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案将26g CO和O2的混合气体充入一体积固定不变的密闭容器中(容器内有足量的Na2O2固体),此时容器的压强为p1,用电火花不间断地点燃,使其充分反应,恢复至原温度,结果固体增重14g,此时容器的压强为p2,则p1:p2为
| A.9:4 | B.7:3 | C.7:6 | D.6:7 |
下列物质既能与NaOH溶液反应,又能与盐酸反应的是
A.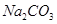 | B.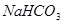 | C.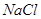 | D. |
利用下图装置做铝热反应实验。下列说法不正确的是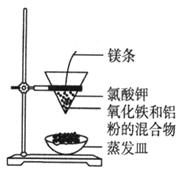
A.该反应的化学方程式是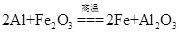 |
| B.该反应会产生高温、发出强光 |
| C.根据铝热反应的原理,可以冶炼某些金属 |
| D.若反应中转移3 mol电子,则消耗氧化剂的物质的量是1 mol |
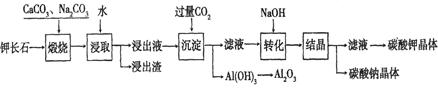
 Al(OH)3+ OH-。“浸取”时应保持溶液呈________性(填“酸”或“碱”),“浸取”时不断搅拌的目的是_____ ____。
Al(OH)3+ OH-。“浸取”时应保持溶液呈________性(填“酸”或“碱”),“浸取”时不断搅拌的目的是_____ ____。