题目内容
【题目】2017年4月,中国科学院长春应用化学研究所研究员张新波课题组提出并论证了基于反应6Li+N2![]() 2Li3N,通过Li-N2可充电电池直接利用空气中的氮气实现人工固氮的可能性。电Li-N2池的结构如图所示,电解液为LiCF3SO3。下列说法正确的是
2Li3N,通过Li-N2可充电电池直接利用空气中的氮气实现人工固氮的可能性。电Li-N2池的结构如图所示,电解液为LiCF3SO3。下列说法正确的是
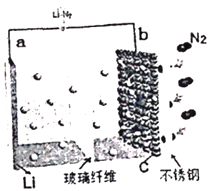
A. b极为电池的负极
B. 电池放电时Li+移向a极
C. b极的电极方程式为N2+6Li++6e- = 2Li3N
D. 金属锂在放电过程中发生还原反应
【答案】C
【解析】
根据原电池的基本原理分析作答,Li→Li3N,元素化合价升高,失电子,被氧化,发生氧化反应,生成的锂离子移向正极;正极氮气参与反应,得电子,发生还原反应,再结合电荷守恒与原子守恒规律,书写出其电极方程式,进行判断。
A. 根据总反应式:6Li+N2![]() 2Li3N可知,Li转化为Li3N,锂元素化合价升高,失电子,在负极发生氧化反应,则a极为电池负极,b极为电池的正极,故A项错误;
2Li3N可知,Li转化为Li3N,锂元素化合价升高,失电子,在负极发生氧化反应,则a极为电池负极,b极为电池的正极,故A项错误;
B. 电池放电时溶液中的阳离子移向电源的正极,即Li+会移向b极,故B项错误;
C. 该电池的正极反应式为:N2+6Li++6e- = 2Li3N,故C项正确;
D. 金属锂在放电过程中化合价升高,失电子,发生氧化反应,故D项错误;
答案选C。

 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案【题目】在一定温度下,10 mL 4.0 mol/L H2O2发生分解:2H2O2![]() H2O+ O2
H2O+ O2![]() ,不同时刻测定生成O2的体积(已折算为标准状况)如下表:
,不同时刻测定生成O2的体积(已折算为标准状况)如下表:
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
下列叙述正确的是(溶液体积变化忽略不计)
A. 6 min时反应速率υ(H2O2) = 3.33×10-2 mol/(L·mol)
B. 反应到6 min时,H2O2分解率为50%
C. 其他条件不变,若换用更高效的催化剂,达到平衡时将会得到更多氧气
D. 随时间增长得到的氧气更多,说明反应速率逐渐加快