题目内容
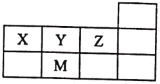
【题目】四种短周期元素在周期表中的相对位置如下所示,其中Z元素原子核外电子总数是其最外层电子数的3倍。
X | Y | |
Z | W |
请回答下列问题:
(1)元素Z位于周期表中第_______周期,_______族;
(2)这些元素的氢化物中,水溶液碱性最强的是_____________(写化学式);
(3)XW2的电子式为________________________;
(4)Y的最高价氧化物的化学式为_________________。
【答案】3 ⅤA NH3 ![]() N2O5
N2O5
【解析】
根据四种短周期元素在周期表中的相对位置可知,X、Y位于第二周期,Z、W位于第三周期,其中Z元素原子核外电子总数是其最外层电子数的3倍,设核外最外层电子数为x,则有(2+8+x)=3x,解得x=5,则Z为P,X为C,Y为N,W为S,据此回答。
(1)元素Z为P,有3个电子层,最外层有5个电子,所以元素Z位于周期表中第3周期VA族。
(2)它们的气态氢化物分别为CH4—难溶于水、NH3—溶于水显碱性、PH3—溶于水显碱性、H2S —溶于水显酸性,PH3微溶于水,其水溶液的碱性弱于氨水,所以这些元素的氢化物中,水溶液碱性最强的是NH3。
(3)X为C,W为S,XW2的电子式为![]() 。
。
(4)Y为N,其最高价氧化物的化学式为N2O5。

【题目】Ⅰ、反应A(g)+B(g)![]() C(g)+D(g)过程中的能量变化如图所示,回答下列问题.
C(g)+D(g)过程中的能量变化如图所示,回答下列问题.

(1)该反应是_________反应(填“吸热”、“放热”)。
(2)当反应达到平衡时,升高温度,A的转化率_______(填“增大”、“减小”、“不变”)。
(3)反应体系中加入催化剂对反应热是否有影响?_____(填“有”、“无”),原因是____。
(4)在反应体系中加入催化剂,反应速率增大,E1的变化是:E1____(填“增大”、“减小”、“不变”)。
Ⅱ、五氯化磷(PCl5)是有机合成中重要的氯化剂,可以由三氯化磷(PCl3)氯化得到:PCl3(g)+Cl2(g) ![]() PCl5(g) △H=-0.930 kJmol-1 。某温度下,在容积恒定为2.0L的密闭容器中充入2.0 mol PCl3和1.0 mol Cl2,一段时间后反应达平衡状态,实验数据如下表所示:
PCl5(g) △H=-0.930 kJmol-1 。某温度下,在容积恒定为2.0L的密闭容器中充入2.0 mol PCl3和1.0 mol Cl2,一段时间后反应达平衡状态,实验数据如下表所示:
t/s | 0 | 50 | 150 | 250 | 350 |
n(PCl5)/mol | 0 | 0.24 | 0.36 | 0.40 | 0.40 |
(1)50~150s内的平均反应速率v(PCl3)=___________。
(2)该温度下,此反应的化学平衡常数的数值为___________。
(3)反应至250s时,该反应放出的热量为______________kJ。
(4)下列关于上述反应的说法中,正确的是__________(填字母序号)。
a.无论是否达平衡状态,混合气体的密度始终不变
b.300s时,升高温度,正、逆反应速率同时增大
c.350s时,向该密闭容器中充入氮气,平衡向正反应方向移动
d.相同条件下,若起始向该密闭容器中充入1.2molPCl3、0.5molCl2 和0.15mol PCl5,则反应向正反应方向进行