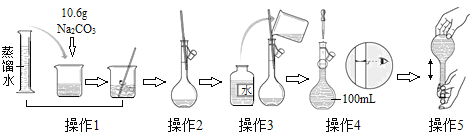
题目内容
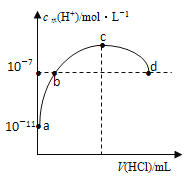
【题目】25℃时,将0.1 mol/L的NaOH溶液滴入盛有50 mLpH=2 的HA溶液的绝热容器中,加入NaOH溶液的体积V与溶液温度T的关系如图。下列说法正确的是( )

A.a点溶液中,c(A-)+c(HA)=0.08 mol/L
B.b点溶液中,c(A-)<c(Na+)
C.a→b的过程中,发生了吸热反应
D.溶液中HA的电离平衡常数a点等于b点
【答案】B
【解析】
由图象可知,加入NaOH 40 mL时温度最高,说明恰好完全反应,则50 mLHA的物质的量为0.1 mol/L×0.04L=0.004 mol,c(HA)=![]() =0.08 mol/L,而溶液的pH=2,说明HA为弱电解质,以此解答该题。
=0.08 mol/L,而溶液的pH=2,说明HA为弱电解质,以此解答该题。
A.a点溶液中,溶液的体积为50mL+10mL=60mL,c(A-)+c(HA)=![]() =0.067 mol/L,A错误;
=0.067 mol/L,A错误;
B.b点时酸、碱恰好完全反应,生成强碱弱酸盐,由以上分析可知HA为弱电解质,因此溶液中A-发生水解反应而消耗,最终达到平衡时:溶液呈碱性,则c(A-)<c(Na+),B正确;
C.a到b的过程发生酸碱中和反应,酸、碱中和反应为放热反应,C错误;
D.弱电解质在溶液中存在电离平衡,升高温度,促进弱电解质的电离,电离常数增大,所以电离平衡常数:b点>a点,D错误;
故合理选项是B。

【题目】合成氨是人类科学技术发展史上的一项重大突破,研究表明液氨是一种良好的储氢物质。
(1) 氨气分解反应的热化学方程式如下:2NH3(g) =N2(g)+3H2(g) ΔH,若:N≡N键、H-H键和N-H键的键能分别记作a、b和c(单位:kJ·mol1),则上述反应的ΔH=________kJ·mol1。
(2) 研究表明金属催化剂可加速氨气的分解。下表为某温度下等质量的不同金属分别催化等浓度氨气分解生成氢气的初始速率(mmol·min1)。
催化剂 | Ru | Rh | Ni | Pt | Pd | Fe |
初始速率 | 7.9 | 4.0 | 3.0 | 2.2 | 1.8 | 0.5 |
不同催化剂存在下,氨气分解反应活化能最大的是________(填写催化剂的化学式)。
(3) 电化学法也可合成氨。如图是用低温固体质子导体作为电解质,用PtC3N4作阴极催化剂电解H2(g)和N2(g)合成NH3的原理示意图:
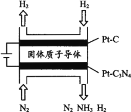
PtC3N4电极反应产生NH3的电极反应式________。
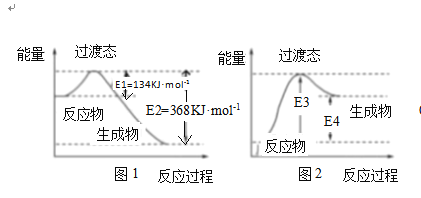
(4)过渡态理论认为:化学反应并不是通过简单的碰撞就能完成的,而是从反应物到生成物的过程中经过一个高能量的过渡态。如图1为1molNO2与1molCO恰好反应生成CO2和NO过程中的能量变化示意图
①试写出NO2和CO反应的热化学方程式:______
②在密闭容器中进行的上述反应是可逆反应,图2是某学生模仿图1画出的NO+CO2 =NO2+CO的能量变化示意图。则图中E3=______kJmol-1
【题目】实验室常用亚硫酸钠固体和70%的浓硫酸制备SO2气体,反应方程式为Na2SO3+H2SO4=Na2SO4+SO2↑+H2O,请设计一套实验装置,收集一试管干燥的SO2气体。
(1)在下面方框中,A表示由分液漏斗和锥形瓶组成的气体发生器,请在答题卡上的A后完成该反应的实验装置示意图(夹持装置、连接胶管不必画出,尾气处理部分必须画出,需要加热的仪器下方用△标出),按气流方向在每件仪器下方标出字母B、C…;其它可选用的仪器(数量不限)简易表示如下:___
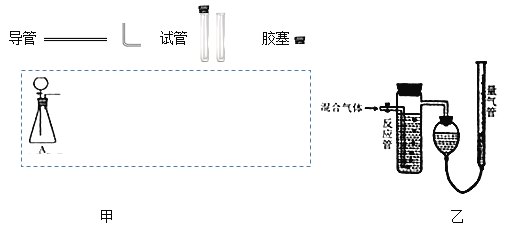
(2)根据方框中的装置图甲,在答题卡上填写下表(可不填满)___
仪器标号 | 仪器中所加物质 | 作用 |
A | 亚硫酸钠、浓硫酸 | 产生SO2 |
(3)某实验小组用如图乙装置测定收集到的气体中SO2的含量,反应管中装有酸性高猛酸钾溶液。
①SO2和酸性高猛酸钾溶液发生反应的离子方程式为:___。
②反应管内溶液紫红色消失后,若没有及时停止通气,则测得的SO2含量___(选填:“偏高”、“偏低”或“无影响”)
③若酸性高猛酸钾溶液体积为V1mL,浓度为cmol/L,量气管内增加的水的体积为V2mL(已折算成标准状况下的体积)。用c、V1、V2表示SO2的体积百分含量为___。