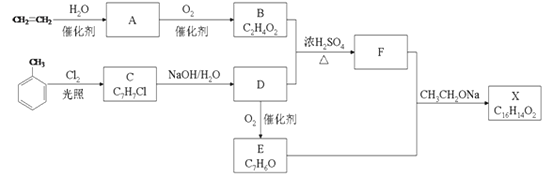
题目内容
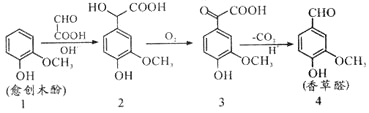
【题目】以黄铁矿烧渣(主要成分为Fe2O3及少量的FeS、SiO2、Cu、Au、Ag等)为原料制备颜料铁红(Fe2O3)、晶体E,回收H和重金属混合物的生产工艺流程如图所示:

请按要求回答下列问题:
(1)工艺流程的中间产物(NH4)2Fe6(SO4)4(OH)12中Fe的化合价为__。Fe在周期表中的位置为第___周期第VIII族。
(2)将烧渣溶解前需进行“粉碎和提高温度”的目的是___。过程①溶解烧渣所需试剂中溶质的化学式为___。反应②的化学方程式:___。
(3)反应③的目的是___。气体Z的电子式:___。写出反应④的离子方程式:__。
(4)将回收的H溶于少量水,所得溶液中所有离子的浓度由大到小依次是___。
【答案】+3 四 提高烧渣溶解速率和溶出率 H2SO4 SiO2+2NaOH=Na2SiO3+H2O 将+2价铁氧化为+3价铁 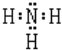 3NH3H2O+Fe3+=Fe(OH)3↓+3NH4+ c(NH4+)>c(SO42-)>c(H+)>c(OH-)
3NH3H2O+Fe3+=Fe(OH)3↓+3NH4+ c(NH4+)>c(SO42-)>c(H+)>c(OH-)
【解析】
黄铁矿烧渣,主要成分为Fe2O3及少量的FeS、SiO2、Cu、Au、Ag等,加入硫酸溶解,滤渣中含有Cu, Au、Ag的活泼性比铜弱,所以滤渣中除了SiO2、Cu,还有Au、Ag;溶液A中的溶质是FeSO4;(NH4)2Fe6(SO4)4(OH)12中Fe的化合价为+3,说明试剂X把溶液A中的Fe2+氧化为Fe3+;溶液B中的溶质是Fe2(SO4)3,通入氨气生成(NH4)2Fe6(SO4)4(OH)12,溶液C是硫酸铵;(NH4)2Fe6(SO4)4(OH)12的水溶液中继续通氨气,生成氢氧化铁沉淀,氢氧化铁加热分解为氧化铁。
(1)(NH4)2Fe6(SO4)4(OH)12中,铵根离子、硫酸根离子、氢氧根离子的总化合价分别为+1、-2、-1,设Fe的化合价为x,则(+1)×2+6x+(-2)×4+(-1)×12=0,解得:x=+3;Fe的原子序数为26,位于元素周期表中第四周期第VIII族;
(2)将烧渣溶解前需进行“粉碎和提高温度”,目的是加快反应速率,从而提高烧渣溶解速率和溶出率;根据分析可知,过程①溶解烧渣所用试剂为硫酸,溶质的化学式为H2SO4;滤渣中除了SiO2、Cu,还有Au、Ag,加入试剂Y溶解SiO2,回收金属,所以Y是氢氧化钠溶液,反应②为氢氧化钠与二氧化硅的反应,该反应的化学方程式为:SiO2+2NaOH=Na2SiO3+H2O;
(3)晶体E(NH4)2Fe6(SO4)4(OH)12中Fe元素化合价为+3,则过量的试剂X目的是将+2价铁氧化为+3价铁;气体Z为氨气,氨气为共价化合物,其电子式为![]() ;反应④为铁离子与氨水反应生成氢氧化铁沉淀,该反应的离子方程式为3NH3H2O+Fe3+=Fe(OH)3↓+3NH4+;
;反应④为铁离子与氨水反应生成氢氧化铁沉淀,该反应的离子方程式为3NH3H2O+Fe3+=Fe(OH)3↓+3NH4+;
(4)根据分析,H为(NH4)2SO4,铵根离子水解溶液呈酸性,则c(H+)>c(OH-),由于铵根离子的水解程度较小,则c(NH4+)>c(SO42-),溶液中离子浓度大小为c(NH4+)>c(SO42-)>c(H+)>c(OH-)。

 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案【题目】直接排放含SO2的烟气会形成酸雨,危害环境。利用钠、碱循环法可脱除烟气中的SO2。
(1)用化学方程式表示SO2形成硫酸型酸雨的反应:____。
(2)在钠、碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是_____。
(3)吸收液吸收SO2的过程中,pH随n(SO32-)∶n(HSO3-)变化关系如表:
n(SO32-)∶n(HSO3-) | 91∶9 | 1∶1 | 1∶91 |
pH | 8.2 | 7.2 | 6.2 |
上表判断NaHSO3溶液显___性,用化学平衡原理解释:___。