题目内容
【题目】化学反应过程中发生物质变化的同时,常常伴有能量的变化。这种能量的变化常以热量的形式表现出来,叫做反应热。由于反应的情况不同,反应热可分为许多种,如燃烧热和中和热等。
(1)10g氢气燃烧生成气态水,放出1209kJ热量,若H2O(1)=H2O(g) △H=+44kJ/mol,写出表示氢气燃烧热的热化学方程式:______。
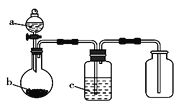
(2)利用50mL0.25molL-1硫酸、50mL 0.55molL-1NaOH溶液,在如图所示装置中测定中和热,回答下列问题:
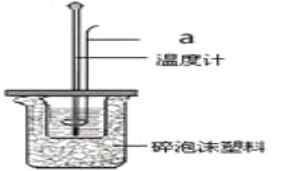
①仪器a的名称是_____。
②使用下列用品不是为了减小实验误差的是______。
A.两个量筒 B.仪器a C.泡沫塑料板 D.碎泡沫塑料
③向装有盐酸的小烧杯中倒入NaOH溶液的正确操作是____。
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次性迅速倒入
④假设硫酸和氢氧化钠溶液的密度都是1gcm-3,又知中和反应后生成溶液的比热容c=4.18Jg-1℃-1,△t=3.4℃,该实验测得的中和热数值为____。(保留一位小数)
⑤下列操作不会使测量的中和热数值改变的是___。
A.用温度计测定NaOH溶液起始温度后直接测定硫酸的温度
B.结合日常生活实际该实验在保温杯中进行
C.用 0.275molL-1Ba(OH)2溶液代替氢氧化钠溶液
D.把仪器a改为铜制品
E.用60mL 0.5molL-1盐酸与50mL 0.55molL-1 NaOH溶液反应
F.用0.5molL-1醋酸代替硫酸
【答案】H2(g)+1/2O2(g)=H2O(l),![]() H=﹣285.8kJmol﹣1 环形玻璃搅拌棒 A C 56.8 BE
H=﹣285.8kJmol﹣1 环形玻璃搅拌棒 A C 56.8 BE
【解析】
(1)依据条件和热化学方程式的书写方法首先书写1mol氢气燃烧生成水蒸气时的热化学方程式,再利用盖斯定律求出生成液态水时的热化学方程式;
(2)①根据量热计的构造来判断仪器;
②环形玻璃棒,使溶液混合更均匀,测量更准确;碎泡沫塑料和底部垫纸条,目的是保温,以减小实验中的误差;
③测定中和热时,应将NaOH溶液一次迅速倒入装有盐酸的烧杯中;
④根据Q=mc△T计算出反应放出的热量,然后计算出生成1mol水放出的热量,就可以得到中和热;
⑤
(1)10g氢气燃烧生成气态水,放出1209kJ热量,则1molH2燃烧生成气态水放出的热量为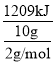 =241.8 kJmol1,即热化学方程式为:又H2(g)+1/2O2(g)=H2O(g),
=241.8 kJmol1,即热化学方程式为:又H2(g)+1/2O2(g)=H2O(g),![]() H=﹣241.8 kJmol-1①,H2O(1)=H2O(g) △H=+44kJmol1②,则依据盖斯定律可得①-②得到H2(g)+1/2O2(g)=H2O(l),
H=﹣241.8 kJmol-1①,H2O(1)=H2O(g) △H=+44kJmol1②,则依据盖斯定律可得①-②得到H2(g)+1/2O2(g)=H2O(l),![]() H=﹣285.8kJmol﹣1,故答案为:H2(g)+1/2O2(g)=H2O(l),
H=﹣285.8kJmol﹣1,故答案为:H2(g)+1/2O2(g)=H2O(l),![]() H=﹣285.8kJmol﹣1;
H=﹣285.8kJmol﹣1;
(2)①仪器a的名称是环形玻璃搅拌棒,故答案为:环形玻璃搅拌棒;
②环形玻璃棒,使溶液混合更均匀,测量更准确;碎泡沫塑料和泡沫塑料板,目的是保温,以减小实验中的误差;量筒是测量溶液体积的,不能减少实验误差,故选A;
③倒入NaOH溶液时,必须一次迅速的倒入,目的是减少热量的散失,否则会导致热量散失,影响测定结果,故选C.
④50mL 0.50molL1盐酸、50mL 0.55molL1 NaOH溶液进行中和反应,生成水的物质的量为0.05L×0.50mol/L=0.025mol,溶液的质量为100mL×1g/cm3=100g,温度变化的值为△t=3.4℃,则生成0.025mol水放出的热量为Q=mc△T=100g×4.18J/(g℃)×3.4℃=1421.2J,即1.4212 kJ,所以实验测得的中和热△H=![]() = 56.8 kJ/mol,
= 56.8 kJ/mol,
故答案为:56.8;
⑤ A.用温度计测定NaOH溶液起始温度后直接测定硫酸的温度,则硫酸的起始温度偏高,温差偏小,使测试结果偏低,A项错误;
B.结合日常生活实际该实验在保温杯中进行,不会使实验结果造成误差,B项正确;
C.用 0.275molL-1Ba(OH)2溶液代替氢氧化钠溶液,则硫酸与Ba(OH)2溶液反应除了生成水外,还生成了BaSO4沉淀,该反应中的生成热会影响反应的反应热,影响测试结果,C项错误;
D.把仪器a改为铜制品,铜会传热,会造成热损失,影响实验结果,D项错误;
E.中和热是指稀的强酸与强碱反应生成1mol水所放出的热量,用60mL 0.5molL-1盐酸与50mL 0.55molL-1 NaOH溶液反应不影响中和热的测定,E项正确;
F.醋酸为弱酸,电离会吸热,则用0.5molL-1醋酸代替硫酸,会影响实验结果,F项错误;
答案为BE。

【题目】利用如图装置制取下表中的四种气体(图中夹持仪器已略去;a、b、c表示相应仪器中加入的试剂),能达到实验目的的是( )
选项 | 气体 | a | b | c |
|
A | H2 | 稀硫酸 | Zn | 浓硫酸 | |
B | CO2 | 盐酸 | CaCO3 | 饱和碳酸氢钠溶液 | |
C | NH3 | 浓氨水 | CaO | 浓硫酸 | |
D | Cl2 | 浓盐酸 | MnO2 | 饱和食盐水 |
A.AB.BC.CD.D
【题目】已知25℃、101 kPa时某些物质的燃烧热数据如下:
名称 | 化学式 | ΔH (kJ/mol) | 名称 | 化学式 | ΔH (kJ/mol) |
石墨 | C(s) | 393.5 | 乙烷 | C2H6(g) | 1560 |
金刚石 | C(s) | 395.0 | 乙烯 | C2H4(g) | 1411 |
氢气 | H2(g) | 285.8 | 乙炔 | C2H2(g) | 1300 |
一氧化碳 | CO(g) | 283.0 | 乙醇 | C2H5OH(l) | 1367 |
(1)相同质量的上述八种物质,完全燃烧放热最多的名称是____。
(2)石墨与金刚石互为____。
a.同位素 b.同素异形体 c.同分异构体 d.同系物
常温常压下,二者更稳定的是___。(填中文名称)
(3)在标准状况下,22.4LCO和C2H2的混合气体在过量的氧气中完全燃烧放出1096.6 kJ的热,则燃烧产生的CO2的物质的量为___mol。
(4)估算在Ni作催化剂时,乙烯与氢气发生加成反应的焓变。C2H4(g)+H2(g)=C2H6(g) ΔH=____。
(5)已知破坏下列化学键需要吸收的能量如下:
C-C | C=C | H-H |
347kJ/mol | 619kJ/mol | 436kJ/mol |
根据(4)的结论,估算C-H键的键能为____kJ/mol。
a.322.5 b.422.5 c.522.5 d.622.5
【题目】![]() 主要用作选矿剂、伪装涂料的颜料等。用钴矿石
主要用作选矿剂、伪装涂料的颜料等。用钴矿石![]() 含
含![]() 、CoO及少量
、CoO及少量![]() 、
、![]() 、
、![]() 等
等![]() 生产
生产![]() 的流程如图1:
的流程如图1:

下表列出了几种离子生成氢氧化物沉淀的pH![]() “沉淀完全”是指溶液中离子浓度低于
“沉淀完全”是指溶液中离子浓度低于![]()
|
|
|
|
| |
开始沉淀的pH |
|
|
|
|
|
沉淀完全的pH |
|
|
|
|
|
![]() 写出“浸取”步骤
写出“浸取”步骤![]() 发生反应的离子方程式______。
发生反应的离子方程式______。
![]() “浸取”步骤除
“浸取”步骤除![]() 外,钴矿石中还能被
外,钴矿石中还能被![]() 还原的物质有______。
还原的物质有______。
![]() 加
加![]() 的目的是氧化
的目的是氧化![]() ,
,![]() 的用量过多会造成的不良后果是______。
的用量过多会造成的不良后果是______。
![]() “沉钴”步骤向
“沉钴”步骤向![]() 溶液加入
溶液加入![]() 溶液需要
溶液需要![]() 条件下进行,适宜的加热方式为______。温度控制在
条件下进行,适宜的加热方式为______。温度控制在![]() 的原因为______。
的原因为______。
![]()
![]() 的实验方案:向“氧化”后的溶液中加入______,加入
的实验方案:向“氧化”后的溶液中加入______,加入![]() 溶液沉钴得
溶液沉钴得![]() 实验中须使用试剂:
实验中须使用试剂:![]() 溶液、金属萃取剂、盐酸
溶液、金属萃取剂、盐酸![]() 。
。