题目内容
已知将盐酸滴入酸性高锰酸钾溶液中,产生黄绿色气体,而溶液的紫红色褪去.现有一个氧化还原反应的体系中共有HCl、Cl2、H2O、KMnO4、MnCl2、KCl六种物质:
(1)写出一个包含上述六种物质的配平的氧化还原反应方程式,并用单线桥标出电子转移方向和数目:______.
(2)上述反应中,氧化剂是______,1mol氧化剂在反应中得到的电子数目为______;生成的氧化产物的物质的量为______.
(3)如果在反应后的溶液中加入NaBiO3,溶液又变紫红色.说出NaBiO3的一个性质:______.
(1)写出一个包含上述六种物质的配平的氧化还原反应方程式,并用单线桥标出电子转移方向和数目:______.
(2)上述反应中,氧化剂是______,1mol氧化剂在反应中得到的电子数目为______;生成的氧化产物的物质的量为______.
(3)如果在反应后的溶液中加入NaBiO3,溶液又变紫红色.说出NaBiO3的一个性质:______.
(1)化合价升高元素是氯元素,在反应中共失去电子10mol,化合价降低元素是锰元素,在反应中共得到电子10mol,氧化还原反应中转移的电子数目为10mol,所以: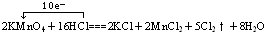 ,故答案为:
,故答案为: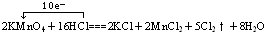 ;
;
(2)化合价降低的元素是锰元素,所在反应物KMnO4是氧化剂,消耗2molKMnO4转移10mol的电子,得到氧化产物氯气5mol,所以1mol氧化剂KMnO4在反应中得到5mol电子,即5NA个,生成氯气2.5mol,故答案为:KMnO4;5NA;2.5mol;
(3)在反应后的溶液中加入NaBiO3,溶液又变紫红色,说明锰离子成为高锰酸根,所以NaBiO3具有强氧化性,能将锰离子氧化,故答案为:NaBiO3具有强氧化性(比KMnO4氧化性强).
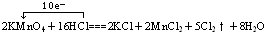 ,故答案为:
,故答案为: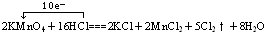 ;
;(2)化合价降低的元素是锰元素,所在反应物KMnO4是氧化剂,消耗2molKMnO4转移10mol的电子,得到氧化产物氯气5mol,所以1mol氧化剂KMnO4在反应中得到5mol电子,即5NA个,生成氯气2.5mol,故答案为:KMnO4;5NA;2.5mol;
(3)在反应后的溶液中加入NaBiO3,溶液又变紫红色,说明锰离子成为高锰酸根,所以NaBiO3具有强氧化性,能将锰离子氧化,故答案为:NaBiO3具有强氧化性(比KMnO4氧化性强).

练习册系列答案
相关题目

 □Cu2++□Fe2++□( )+□SO42-
□Cu2++□Fe2++□( )+□SO42-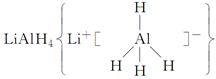 、LiH既是金属储氢材料又是有机合成中的常用试剂,遇水均能剧烈反应放出H2,LiAlH4在125 ℃分解为LiH、H2和Al。下列说法中不正确的是 ( )。
、LiH既是金属储氢材料又是有机合成中的常用试剂,遇水均能剧烈反应放出H2,LiAlH4在125 ℃分解为LiH、H2和Al。下列说法中不正确的是 ( )。