题目内容
(1)亚硫酸钠和碘酸钾在酸性溶液中发生以下反应:
______Na2SO3+______KIO3+______H2SO4--______Na2SO4+______K2SO4+______I2+______H2O
①配平上面的氧化还原反应方程式,将化学计量数填入方框中.
②其中氧化剂是______.
③若反应中有5mol电子转移,则生成碘的物质的量是______mol
(2)完成表格中的内容:
(3)勒夏特列原理:如果改变影响平衡的一个条件(如浓度、温度、压强等).平衡就向着能够______的方向移动.
______Na2SO3+______KIO3+______H2SO4--______Na2SO4+______K2SO4+______I2+______H2O
①配平上面的氧化还原反应方程式,将化学计量数填入方框中.
②其中氧化剂是______.
③若反应中有5mol电子转移,则生成碘的物质的量是______mol
(2)完成表格中的内容:
| 改变的条件 | 平衡移动的方向 | 平衡移动的过程 |
| 增大反应物的浓度 | ______ | 反应物的浓度______ |
| 减小压强 | ______ | 体系的压强逐渐______ |
| 升高温度 | ______ | 体系的温度逐渐______ |
| 使用合适的催化剂 | ______ | 速率______ 达平衡所需时间______ |
(1)①反应中S元素化合价由Na2SO3中+4价升高为+6价,总共升高2价,I元素化合价由KIO3中+5降低为I2中0价,总共降低10价,化合价最小公倍数为10,故Na2SO3系数为5,故I2系数为1,再结合原子守恒配平后方程式为5Na2SO3+2KIO3+H2SO4═5Na2SO4+K2SO4+I2+H2O,
故答案为:5;2;1;5;1;1;1;
②该反应中,碘元素的化合价由+5价变为0价,硫元素的化合价由+4价变为+6价,所以氧化剂是KIO3,
故答案为:KIO3;
③碘元素的化合价由+5价变为0价,生成1mol碘单质时转移10mol电子,若反应中有5mol电子转移,则生成的碘的物质的量=
=0.5mol,
故答案为:0.5;
(2)增大反应物的浓度,平衡正向移动,平衡移动的过程反应物的浓度减小;减小压强,平衡向气体体积增大方向移动,平衡移动的过程体系的压强逐渐增大;升高温度,平衡向吸热方向移动,平衡移动的过程体系的温度逐渐降低;使用合适的催化剂,平衡不移动,速率加快,达平衡所需时间缩短,
故答案为:
(3)勒夏特列原理:如果改变影响平衡的一个条件(如浓度、温度、压强等).平衡就向着能够减弱这种改变的方向移动,
故答案为:减弱这种改变.
故答案为:5;2;1;5;1;1;1;
②该反应中,碘元素的化合价由+5价变为0价,硫元素的化合价由+4价变为+6价,所以氧化剂是KIO3,
故答案为:KIO3;
③碘元素的化合价由+5价变为0价,生成1mol碘单质时转移10mol电子,若反应中有5mol电子转移,则生成的碘的物质的量=
| 5mol |
| 10 |
故答案为:0.5;
(2)增大反应物的浓度,平衡正向移动,平衡移动的过程反应物的浓度减小;减小压强,平衡向气体体积增大方向移动,平衡移动的过程体系的压强逐渐增大;升高温度,平衡向吸热方向移动,平衡移动的过程体系的温度逐渐降低;使用合适的催化剂,平衡不移动,速率加快,达平衡所需时间缩短,
故答案为:
| 改变的条件 | 平衡移动的方向 | 平衡移动的过程 |
| 增大反应物的浓度 | 正向移动 | 反应物的浓度减小 |
| 减小压强 | 向气体体积增大方向移动 | 体系的压强逐渐增大 |
| 升高温度 | 向吸热方向移动 | 体系的温度逐渐降低 |
| 使用合适的催化剂 | 平衡不移动 | 速率加快 达平衡所需时间缩短 |
故答案为:减弱这种改变.

练习册系列答案
相关题目
 KOCN+2KCl+H2O。被氧化的元素是___________。
KOCN+2KCl+H2O。被氧化的元素是___________。
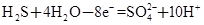 ②
②