题目内容
(2010?沈阳二模)已知碳酸、亚硫酸、次氯酸的平衡常数如下表:
|
分析:由平衡常数可知,平衡常数越大,酸性越强,可得酸性顺序:H2SO3>H2CO3>HSO3->HClO>HCO3-,根据酸性强弱判断反应能否进行,注意HClO具有强氧化性,SO2具有还原性,二者可发生氧化还原反应.
解答:解:A.酸性HClO>HCO3-,NaClO溶液中通少量CO2应生成HCO3-,反应的离子方程式为ClO-+CO2+H2O=HClO+HCO3-,故A错误;
B.酸性H2SO3>H2CO3>HSO3->HCO3-,Na2CO3溶液中通少量SO2生成HCO3-,反应的离子方程式为2CO32-+SO2+H2O=2HCO3-+SO32-,故B正确;
C.酸性H2SO3>H2CO3>HSO3-,NaHCO3溶液中通少量SO2反应的离子方程式为HCO3-+SO2=CO2+HSO3-,故C错误;
D.HClO具有强氧化性,SO2具有还原性,二者可发生氧化还原反应,NaClO溶液中通少量SO2应生成SO42-,故D错误.
故选B.
B.酸性H2SO3>H2CO3>HSO3->HCO3-,Na2CO3溶液中通少量SO2生成HCO3-,反应的离子方程式为2CO32-+SO2+H2O=2HCO3-+SO32-,故B正确;
C.酸性H2SO3>H2CO3>HSO3-,NaHCO3溶液中通少量SO2反应的离子方程式为HCO3-+SO2=CO2+HSO3-,故C错误;
D.HClO具有强氧化性,SO2具有还原性,二者可发生氧化还原反应,NaClO溶液中通少量SO2应生成SO42-,故D错误.
故选B.
点评:本题考查离子方程式的书写,题目难度中等,解答本题的关键是根据平衡常数判断酸性强弱,注意D为易错点,HClO具有强氧化性,SO2具有还原性,二者可发生氧化还原反应.

练习册系列答案
相关题目
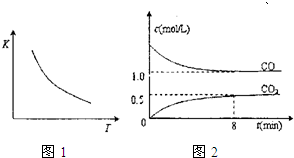 (2010?沈阳二模)一定条件下某密闭容器中发生反应:FeO(s)+CO(g)?Fe(s)+CO2(g),已知该反应的平衡常数(K)的与温度(T)的关系如图1,图2是T1温度下该反应的c-t关系图象.则下列说法正确的是( )
(2010?沈阳二模)一定条件下某密闭容器中发生反应:FeO(s)+CO(g)?Fe(s)+CO2(g),已知该反应的平衡常数(K)的与温度(T)的关系如图1,图2是T1温度下该反应的c-t关系图象.则下列说法正确的是( )