题目内容
(2010?沈阳二模)在研究性学习中,某实验小组进行了铜与稀硝酸反应的实验探究.有三位学生设计了以下三种实验方案.如图所示:

(1)写出稀硝酸与铜反应的化学方程式
(2)甲同学用图1装置进行实验,在圆底烧瓶中加入20mL 6mol/L HNO3和2g薄铜片,在反应开始时,可观察到水槽内的导管中水面先慢慢上升到一定高度,此后又回落,然后有气泡从导管口冒出.试说明产生上述现象的原因
(3)乙同学将甲的实验进行了改进,采用了图2装置进行实验.
①在实验中,要使B中的气体始终保持无色,其操作是
②如果开启a和c,关闭b,装置里液面上空间的体积为VmL,空气中氧气的体积分数为21%,实验在标准状况下进行,全部氧气通过反应转化为硝酸;实验开始时加入的铜为mg,实验完毕后剩余的铜为ng,所得溶液体积也是VmL.则所得溶液的物质的量浓度是
(4)丙同学采用图3装置进行实验,将活塞打开,从U形管的长管口注入稀硝酸,一直注到U形管短管中充满液体时,立即关闭活塞.铜与稀硝酸开始反应产生NO气体.
①当
②为了证明Cu与稀HNO3反应生成的气体是NO,而不是N2,需要的简单操作是
③图3装置与图1、图2装置相比,优点是

(1)写出稀硝酸与铜反应的化学方程式
3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O
3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O
.(2)甲同学用图1装置进行实验,在圆底烧瓶中加入20mL 6mol/L HNO3和2g薄铜片,在反应开始时,可观察到水槽内的导管中水面先慢慢上升到一定高度,此后又回落,然后有气泡从导管口冒出.试说明产生上述现象的原因
由于反应开始时产生的NO与烧瓶内空气中O2作用生成NO2,NO2溶于水并与水反应使装置内气压减小,水倒吸入至一定高度后,当烧瓶中的氧气全部消耗后,生成的NO排出导管口,即有气泡产生
由于反应开始时产生的NO与烧瓶内空气中O2作用生成NO2,NO2溶于水并与水反应使装置内气压减小,水倒吸入至一定高度后,当烧瓶中的氧气全部消耗后,生成的NO排出导管口,即有气泡产生
.(3)乙同学将甲的实验进行了改进,采用了图2装置进行实验.
①在实验中,要使B中的气体始终保持无色,其操作是
先关闭a,开启b和c一段时间,再关b开a
先关闭a,开启b和c一段时间,再关b开a
.②如果开启a和c,关闭b,装置里液面上空间的体积为VmL,空气中氧气的体积分数为21%,实验在标准状况下进行,全部氧气通过反应转化为硝酸;实验开始时加入的铜为mg,实验完毕后剩余的铜为ng,所得溶液体积也是VmL.则所得溶液的物质的量浓度是
0.0125mol?L-1
0.0125mol?L-1
.(4)丙同学采用图3装置进行实验,将活塞打开,从U形管的长管口注入稀硝酸,一直注到U形管短管中充满液体时,立即关闭活塞.铜与稀硝酸开始反应产生NO气体.
①当
硝酸与铜丝脱离接触
硝酸与铜丝脱离接触
时反应、自动停止,在U形管短管上部(或U形管左管上部)
U形管短管上部(或U形管左管上部)
处观察到无色的NO气体.②为了证明Cu与稀HNO3反应生成的气体是NO,而不是N2,需要的简单操作是
再将分液漏斗的活塞慢慢打开,在分液漏斗中观察到气体由无色变为红棕色
再将分液漏斗的活塞慢慢打开,在分液漏斗中观察到气体由无色变为红棕色
.③图3装置与图1、图2装置相比,优点是
能探究出铜与稀硝酸反应生成物为NO,且可以验证NO被氧化成NO2的过程)
能探究出铜与稀硝酸反应生成物为NO,且可以验证NO被氧化成NO2的过程)
.分析:(1)根据金属铜和硝酸的反应情况来书写方程式;
(2)根据一氧化氮和二氧化氮的性质结合大气压强原理来解释;
(3)一氧化氮不和氧气结合即可避开变为二氧化氮的可能;
(4)①根据实验装置的工作原理来判断反应的发生和结束情况;
②一氧化氮和氧气反应生成硝酸的反应为:4NO+3O2+2H2O=4HNO3,根据公式c=
来计算浓度;
③根据装置特点对比来确定反应的优缺点.
(2)根据一氧化氮和二氧化氮的性质结合大气压强原理来解释;
(3)一氧化氮不和氧气结合即可避开变为二氧化氮的可能;
(4)①根据实验装置的工作原理来判断反应的发生和结束情况;
②一氧化氮和氧气反应生成硝酸的反应为:4NO+3O2+2H2O=4HNO3,根据公式c=
| n |
| V |
③根据装置特点对比来确定反应的优缺点.
解答:(1)金属铜能和稀硝酸反应生成硝酸铜、一氧化氮和水,即3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,
故答案为:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O;
(2)根据一氧化氮易和氧气反应的性质,可以得出:由于反应开始时产生的NO与烧瓶内空气中O2作用生成NO2,NO2溶于水并与水反应使装置内气压减小,水倒吸入至一定高度后,当烧瓶中的氧气全部消耗后,生成的NO排出导管口,即有气泡产生,
故答案为:由于反应开始时产生的NO与烧瓶内空气中O2作用生成NO2,NO2溶于水并与水反应使装置内气压减小,水倒吸入至一定高度后,当烧瓶中的氧气全部消耗后,生成的NO排出导管口,即有气泡产生;
(3)①一氧化氮不和氧气结合的途径是先关闭a,开启b和c一段时间,再关b开a,
故答案为:先关闭a,开启b和c一段时间,再关b开a;
②一氧化氮和氧气反应生成硝酸的反应为:4NO+3O2+2H2O=4HNO3,设生成硝酸的物质的量为x,则
4NO+3O2+2H2O=4HNO3
4 3 4
x
则
=
,解得x=0.0125Vmol,根据c=
,则硝酸的浓度是0.0125mol?L-1,故答案为:0.0125mol?L-1;
(4)①硝酸与铜丝脱离接触时,反应即刻停止,此时在U形管短管上部(或U形管左管上部)察到无色的NO气体,
故答案为:硝酸与铜丝脱离接触;U形管短管上部(或U形管左管上部);
②一氧化氮极易和氧气反应生成红棕色的二氧化氮,但是氮气不具有此性质,所以可以再将分液漏斗的活塞慢慢打开,如果在分液漏斗中观察到气体由无色变为红棕色,则证明Cu与稀HNO3反应生成的气体是NO,而不是N2,
故答案为:再将分液漏斗的活塞慢慢打开,在分液漏斗中观察到气体由无色变为红棕色;
③图3装置与图1、图2装置相比,能探究出铜与稀硝酸反应生成物为NO,此外还可以验证NO被氧化成NO2的过程,
故答案为:能探究出铜与稀硝酸反应生成物为NO,且可以验证NO被氧化成NO2的过程.
故答案为:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O;
(2)根据一氧化氮易和氧气反应的性质,可以得出:由于反应开始时产生的NO与烧瓶内空气中O2作用生成NO2,NO2溶于水并与水反应使装置内气压减小,水倒吸入至一定高度后,当烧瓶中的氧气全部消耗后,生成的NO排出导管口,即有气泡产生,
故答案为:由于反应开始时产生的NO与烧瓶内空气中O2作用生成NO2,NO2溶于水并与水反应使装置内气压减小,水倒吸入至一定高度后,当烧瓶中的氧气全部消耗后,生成的NO排出导管口,即有气泡产生;
(3)①一氧化氮不和氧气结合的途径是先关闭a,开启b和c一段时间,再关b开a,
故答案为:先关闭a,开启b和c一段时间,再关b开a;
②一氧化氮和氧气反应生成硝酸的反应为:4NO+3O2+2H2O=4HNO3,设生成硝酸的物质的量为x,则
4NO+3O2+2H2O=4HNO3
4 3 4
| V×21% |
| 22.4 |
则
| 3 | ||
|
| 4 |
| x |
| n |
| V |
(4)①硝酸与铜丝脱离接触时,反应即刻停止,此时在U形管短管上部(或U形管左管上部)察到无色的NO气体,
故答案为:硝酸与铜丝脱离接触;U形管短管上部(或U形管左管上部);
②一氧化氮极易和氧气反应生成红棕色的二氧化氮,但是氮气不具有此性质,所以可以再将分液漏斗的活塞慢慢打开,如果在分液漏斗中观察到气体由无色变为红棕色,则证明Cu与稀HNO3反应生成的气体是NO,而不是N2,
故答案为:再将分液漏斗的活塞慢慢打开,在分液漏斗中观察到气体由无色变为红棕色;
③图3装置与图1、图2装置相比,能探究出铜与稀硝酸反应生成物为NO,此外还可以验证NO被氧化成NO2的过程,
故答案为:能探究出铜与稀硝酸反应生成物为NO,且可以验证NO被氧化成NO2的过程.
点评:本题是一道化学实验方案评价的知识题目,考查学生分析和解决问题的能力,难度大,综合性强.

练习册系列答案
相关题目
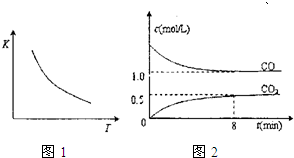 (2010?沈阳二模)一定条件下某密闭容器中发生反应:FeO(s)+CO(g)?Fe(s)+CO2(g),已知该反应的平衡常数(K)的与温度(T)的关系如图1,图2是T1温度下该反应的c-t关系图象.则下列说法正确的是( )
(2010?沈阳二模)一定条件下某密闭容器中发生反应:FeO(s)+CO(g)?Fe(s)+CO2(g),已知该反应的平衡常数(K)的与温度(T)的关系如图1,图2是T1温度下该反应的c-t关系图象.则下列说法正确的是( )