题目内容
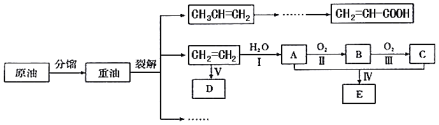
【题目】乙烯是来自石油的重要有机化工原料。结合以下路线回答:
已知:2CH3CHO+O2![]() 2CH3COOH
2CH3COOH
(1)D是高分子,用来制造包装材料,其结构简式是_____;
(2)反应I的化学方程式是_____;反应II的化学方程式是______;
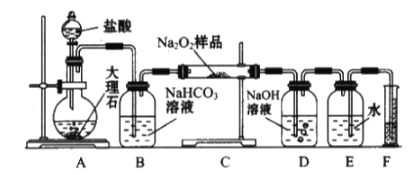
(3)E有香味,实验室用A和C反应制取E的装置如图所示。
①反应IV的化学方程式是______,其反应类型是____;
②试管乙中用____溶液收集E,分离出试管乙中油状液体需要用到的仪器是___(填序号);
a.漏斗 b.分液漏斗 c.长颈漏斗
③实验结束,振荡试管乙,有无色气泡产生,其主要原因是__________(用化学方程式表示)。
(4)产物CH2=CH-COOH可能发生的反应有____(填序号)。
a.加成反应 b.取代反应 c.氧化反应 d.中和反应
【答案】![]() CH2=CH2+H2O
CH2=CH2+H2O![]() CH3CH2OH 2CH3CH2OH+O2
CH3CH2OH 2CH3CH2OH+O2![]() 2CH3CHO+2H2O CH3COOH+C2H5OH
2CH3CHO+2H2O CH3COOH+C2H5OH![]() CH3COOC2H5+H2O 酯化反应或取代反应 饱和Na2CO3溶液 b 2CH3COOH+Na2CO3=2CH3COONa+H2O+CO2↑ abcd
CH3COOC2H5+H2O 酯化反应或取代反应 饱和Na2CO3溶液 b 2CH3COOH+Na2CO3=2CH3COONa+H2O+CO2↑ abcd
【解析】
乙烯含有碳碳双键,与水发生加成反应生成A为CH3CH2OH,乙醇发生催化氧化生成B为CH3CHO,乙醛进一步发生氧化反应生成C为CH3COOH,乙酸与乙醇发生酯化反应生成E为CH3COOCH2CH3,D为高分子化合物,乙烯发生加聚反应生成D为![]() 。
。
(1)D为聚乙烯,其结构简式是![]() ;
;
(2)反应I是乙烯与水在催化剂存在和加热条件下发生反应产生乙醇,反应方程式为CH2=CH2+H2O![]() CH3CH2OH;反应II是乙醇催化氧化生成乙醛,反应化学方程式是:2CH3CH2OH+O2
CH3CH2OH;反应II是乙醇催化氧化生成乙醛,反应化学方程式是:2CH3CH2OH+O2![]() 2CH3CHO+2H2O;
2CH3CHO+2H2O;
(3)①反应IV是乙酸与乙醇在浓硫酸存在和加热条件下发生酯化反应生成乙酸乙酯和水,反应方程式为CH3COOH+C2H5OH![]() CH3COOC2H5+H2O,该反应的类型为酯化(或取代)反应;
CH3COOC2H5+H2O,该反应的类型为酯化(或取代)反应;
②乙中乙酸乙酯与水溶液分层,为了降低乙酸乙酯的溶解度,同时除去挥发的未反应的乙酸,溶解乙醇,乙中一般用饱和的Na2CO3溶液收集乙酸乙酯;分离出试管乙中乙酸乙酯需要用到的仪器是:分液漏斗,故合理选项是b;
③实验结束,振荡试管乙,有无色气泡产生,其主要原因是乙酸与碳酸钠溶液反应产生CO2气体,反应方程式为:2CH3COOH+Na2CO3=2CH3COONa+CO2↑+H2O;
(4)产物CH2=CH-COOH中含有的官能团是碳碳双键和羧基,含有碳碳双键,可以发生加成反应、氧化反应;含有羧基,可以发生中和反应、酯化反应,酯化反应属于取代反应,故合理序号是abcd。

 期末集结号系列答案
期末集结号系列答案【题目】如图所示,利用培养皿进行实验。实验时向NaOH固体上滴几滴浓氨水,立即用另一表面皿扣在上面。
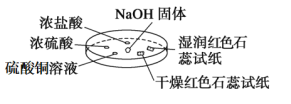
下表中对实验现象所做的解释不正确的是( )
选项 | A | B | C | D |
实验 现象 | 浓盐酸附近产生白烟 | 浓硫酸附近无明显现象 | 干燥红色石蕊试纸不变色,湿润红色石蕊试纸变蓝 | 硫酸铜溶液变浑浊 |
解释 | NH3与HCl反应产生了NH4Cl固体 | NH3与浓硫酸不发生反应 | NH3与水反应生成了NH3·H2O,电离出OH-使红色石蕊试纸变蓝 | 生成Cu(OH)2沉淀 |
A.AB.BC.CD.D