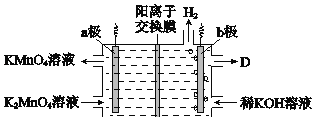
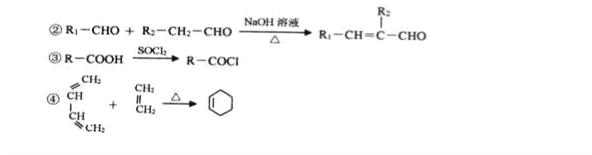
题目内容
【题目】某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择甲基橙作指示剂。请回答下列问题:
(1)观察下图(左),标准液盐酸应放入___________滴定管中。(填“甲”或“乙”)


(2)用标准的盐酸滴定待测的NaOH溶液时,左手握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视__________________________________,滴定终点的现象为_______________。
(3)若滴定开始和结束时,酸式滴定管中的液面如上图(右)所示,则起始读数为___________mL,所用盐酸溶液的体积为___________________mL。
(4)某学生根据3次实验分别记录有关数据如表所示:

依据表中数据计算该NaOH溶液的物质的量浓度________________。
(5)下列操作中可能使所测NaOH溶液的浓度数值偏低的是_____________(填字母序号)。
A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸
B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
【答案】甲 锥形瓶中溶液的颜色变化 当滴入最后一滴盐酸时,溶液刚好由黄色变为橙色且在半分钟内溶液颜色保持不变。 0.00 26.10 0.1044 mol·L-1 D
【解析】
(1)酸性液体盛入酸式滴定管中;(2)眼睛观察的是锥形瓶内指示剂颜色的变化,而不是滴定管中液体的体积变化;判断滴定终点时,注意在指示剂颜色发生变化后,半分钟内不再复原,停止滴定;(3)滴定管的0刻度在上;(4)第二组数据,误差太大,舍去,取第一次和第二次盐酸体积计算平均值,根据c(酸)v(酸)=c(碱)v(碱),计算NaOH溶液的物质的量浓度。(5)根据c(待测)=![]() 分析误差。
分析误差。
(1)甲是酸式滴定管、乙是碱式滴定管,酸性液体盛入酸式滴定管中,所以标准液盐酸应放入甲中;(2)用标准盐酸滴定待测的NaOH溶液时,左手握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视锥形瓶中溶液的颜色变化,滴定终点的现象为当滴入最后一滴盐酸时,溶液刚好由黄色变为橙色且在半分钟内溶液颜色保持不变。(3)滴定管的0刻度在上,由图可知:滴定前刻度0.00,滴定后刻度26.10,溶液体积26.10;(4)第二组数据,误差太大,舍去,取第一次和第二次盐酸体积的平均值:V= (26.11+26.09)/2= 26.10 mL,根据c(酸)v(酸)=c(碱)v(碱),0.1mol/L![]() 26.10 mL= c(NaOH)
26.10 mL= c(NaOH)![]() 25.00 mL,c(NaOH)=0.1044 mol/L;(5)酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸溶液,标准液的浓度偏小,造成V(标准)偏大,根据c(待测)=
25.00 mL,c(NaOH)=0.1044 mol/L;(5)酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸溶液,标准液的浓度偏小,造成V(标准)偏大,根据c(待测)=![]() 可知,测定c(NaOH)偏大,故A不符合;B、滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥,待测液的物质的量不变,对V(标准)无影响,根据c(待测)=
可知,测定c(NaOH)偏大,故A不符合;B、滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥,待测液的物质的量不变,对V(标准)无影响,根据c(待测)=![]() 可知,测定c(NaOH)无影响,故B不符合;C选项酸式滴定管在滴定前有气泡,滴定后气泡消失,造成V(标准)偏大,根据c(待测)=
可知,测定c(NaOH)无影响,故B不符合;C选项酸式滴定管在滴定前有气泡,滴定后气泡消失,造成V(标准)偏大,根据c(待测)=![]() 可知,测定c(NaOH)偏大,故C不符合;D选项,读取盐酸体积时,开始仰视读数,滴定结束时俯视读数,造成V(标准)偏小,根据c(待测)=
可知,测定c(NaOH)偏大,故C不符合;D选项,读取盐酸体积时,开始仰视读数,滴定结束时俯视读数,造成V(标准)偏小,根据c(待测)=![]() 可知,测定c(NaOH)偏低,故D符合。
可知,测定c(NaOH)偏低,故D符合。