题目内容
【题目】某新型有机酰胺化合物M在工业生产中有重要的作用,其合成路线如下:
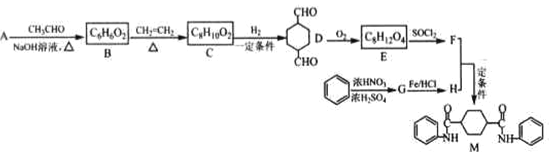
已知:①A是烃的含氧衍生物,相对分子质量为58,碳和氢的质量分数之和为44.8%,核磁共振氢谱显示为一组峰,可发生银镜反应。
回答下列问题;
(1)E的结构简式为________________,G的名称为_____________。
(2)B中含有官能团的名称为__________________
(3)C→D的反应类型为_____________。
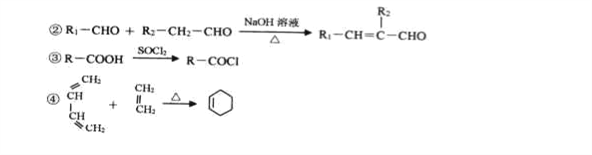
(4)写出B→C的化学反应方程式____________________________.F+H→M的化学反应方程式____________________________
(5)芳香族化合物W有三个取代基,是C的同分异构体,能与FeCl3溶液发生显色反应。0.5molW可与足量的Na反应生成1gH2,且核磁共振氢谱显示为五组峰,符号以上条件的W的同分异构体共有__________种,写出其中一种的结构简式______________。
(7)参照上述合成路线,以C2H4和HOCH2CH2OH为原料(无机试剂任选),设计制备OHC-CH=CH-CHO的合成路线______。
【答案】 ![]() 硝基苯 碳碳双键 醛基 加成反应(或还原反应) OHCCH=CH—CH=CHCHO+CH=CH
硝基苯 碳碳双键 醛基 加成反应(或还原反应) OHCCH=CH—CH=CHCHO+CH=CH ![]()
![]()
 2
2  或
或
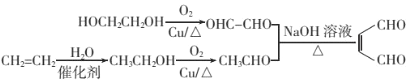
【解析】分析:A是烃的含氧衍生物,相对分子质量为58,碳和氢的质量分数之和为44.8%,则氧元素的质量分数为55.2%,A分子中的O原子数为![]() 、C原子数为
、C原子数为![]() (余数为2),故A的分子式为C2H2O2,A核磁共振氢谱显示为一组峰,可发生银镜反应,则A为乙二醛;由信息②可知,A与乙醛反应生成B,B为OHCCH=CH—CH=CHCHO;由信息④可知,B与乙烯发生加成反应生成C,则C为
(余数为2),故A的分子式为C2H2O2,A核磁共振氢谱显示为一组峰,可发生银镜反应,则A为乙二醛;由信息②可知,A与乙醛反应生成B,B为OHCCH=CH—CH=CHCHO;由信息④可知,B与乙烯发生加成反应生成C,则C为![]() ; C与氢气发生加成反应生成D,D发生氧化反应生成E,则E为
; C与氢气发生加成反应生成D,D发生氧化反应生成E,则E为![]() ;由信息③可知,E与二氯氧硫反应生成F,F为
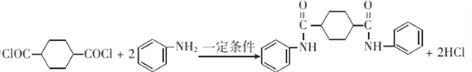
;由信息③可知,E与二氯氧硫反应生成F,F为![]() ;苯发生硝化反应生成G,由M的结构可知,G为硝基苯;G发生还原反应生成H,则H为苯胺;F与H发生取代反应生成M。
;苯发生硝化反应生成G,由M的结构可知,G为硝基苯;G发生还原反应生成H,则H为苯胺;F与H发生取代反应生成M。
详解:(1)E的结构简式为![]() ,G的名称为硝基苯。
,G的名称为硝基苯。
(2)B中含有官能团的名称为碳碳加成反应(或还原反应)双键和醛基。
(3)C→D的反应类型为加成反应(或还原反应)。
(4)B→C的化学反应方程式为OHCCH=CH—CH=CHCHO+CH=CH ![]()
![]() ;F+H→M的化学反应方程式为
;F+H→M的化学反应方程式为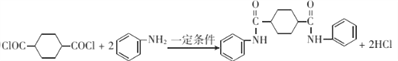 。
。
(5)芳香族化合物W有三个取代基,是C(![]() ,不饱和度等于4)的同分异构体,能与FeCl3溶液发生显色反应,则W分子中有酚羟基、三个取代基均为饱和的;0.5molW可与足量的Na反应生成1gH2,则W分子中有2个羟基;其核磁共振氢谱显示为五组峰。符合以上条件的W的同分异构体有
,不饱和度等于4)的同分异构体,能与FeCl3溶液发生显色反应,则W分子中有酚羟基、三个取代基均为饱和的;0.5molW可与足量的Na反应生成1gH2,则W分子中有2个羟基;其核磁共振氢谱显示为五组峰。符合以上条件的W的同分异构体有 和
和 ,共有2种。
,共有2种。
(7)参照上述合成路线,以C2H4和HOCH/span>2CH2OH为原料制备OHC-CH=CH-CHO,首先把乙二醇催化氧化为乙二醛;再把乙烯与水发生加成反应制备乙醇;接着,乙醇通过催化氧化制备乙醛;最后,乙二醛与乙醛通过信息②的反应合成产品。具体合成路线如下: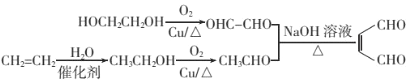 。
。

【题目】下列电离方程式错误的是( )
A.NaHCO3═Na++H++CO32﹣
B.NaHSO4═Na++H++SO42﹣
C.Mg(NO3)2═Mg2++2NO3﹣
D.Na2SO4═2Na++SO42﹣
【题目】乙烯是合成食品外包装材料聚乙烯的单体,可以由丁烷裂解制备。
主反应:C4H10(g,正丁烷)![]() C2H4(g)+C2H6(g) △H1
C2H4(g)+C2H6(g) △H1
副反应:C4H10 (g,正丁烷)![]() CH4(g)+C3H6(g) △H2
CH4(g)+C3H6(g) △H2
回答下列问题:
(1)化学上,将稳定单质的能量定为0,生成稳定化合物时释放或吸收的能量叫做生成热,生成热可表示该物质相对能量。下表为25℃、101kPa下几种有机物的生成热:
物质 | 曱烷 | 乙烷 | 乙烯 | 丙烯 | 正丁烷 | 异丁烷 |
生成热/kJ·mol-1 | -75 | -85 | 52 | 20 | -125 | -132 |
①书写热化学方程式时,要标明“同分异构体名称”,其理由是_______________________。
②上述反应中,△H1=______kJ/mol。
(2)一定温度下,在恒容密闭容器中投入一定量正丁烷发生反应生成乙烯。
①下列情况表明该反应达到平衡状态的是_______(填代号)。
A.气体密度保持不变 B.[c(C2H4)·c(C2H6)]/ c(C4H10)保持不变
C.反应热不变 D.正丁烷分解速率和乙烷消耗速率相等
②为了同时提高反应速率和转化率,可采用的措施是________________。
(3)向密闭容器中充入丁烷,在一定条件(浓度、催化剂及压强等)下发生反应,测得乙烯产率与温度关系如图所示。温度高于600℃时,随若温度升高,乙烯产率降低,可能的原因是__________(填代号)。
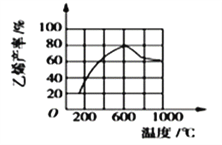
A.平衡常数降低 B.活化能降低
C.催化剂活性降低 D.副产物增多
(4)在一定温度下向1L恒容密闭容器中充入2mol正丁烷,反应生成乙烯和乙烷,经过10min达到平衡状态,测得平衡时气体压强是原来的1.75倍。
①0~10min内乙烯的生成速率v(C2H4)为________mol·L-1·min-1。
②上述条件下,该反应的平衡常数K为____________。
(5)丁烷-空气燃料电池以熔融的K2CO3为电解质,以具有催化作用和导电性能的稀土金属材料为电极。该燃料电池的负极反应式为______________________________。
(6)K2CO3可由二氧化碳和氢氧化钾溶液反应制得。常温下,向1 L pH=10的KOH溶液中持续通入CO2,通入CO2的体积(V)与溶液中水电离出的OH-浓度的关系如图所示。C点溶液中各离子浓度大小关系为_________________________________________。