题目内容
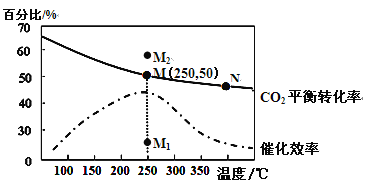
【题目】CO2可作为合成低碳烯烃的原料加以利用。如:2CO2(g)+6H2(g)![]() CH2=CH2(g)+4H2O(g) ΔH= a kJ·mol-1如图所示为在体积为1 L的恒容容器中,投料为3 mol H2和1 mol CO2时,测得的温度对CO2的平衡转化率和催化剂催化效率的影响。
CH2=CH2(g)+4H2O(g) ΔH= a kJ·mol-1如图所示为在体积为1 L的恒容容器中,投料为3 mol H2和1 mol CO2时,测得的温度对CO2的平衡转化率和催化剂催化效率的影响。
已知:H2和CH2=CH2的标准燃烧热分别是-285.8 kJ·mol-1和-1411.0 kJ·mol-1。H2O(g) ![]() H2O(l) ΔH=-44 kJ·mol-1
H2O(l) ΔH=-44 kJ·mol-1
请回答:
(1)a=__________kJ·mol-1。
(2)上述由CO2合成CH2=CH2的反应在____________下自发(填“高温”或“低温”),理由是____________。
(3)计算250 ℃时该反应平衡常数的数值K=____________。
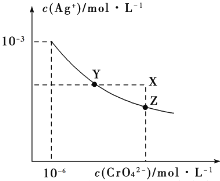
(4)下列说法正确的是____________。
a.平衡常数大小:M>N
b.反应物活化分子百分数大小:M>N
c.其他条件不变,若不使用催化剂,则250℃时CO2的平衡转化率可能位于点M1
d.其他条件不变,若投料改为4 mol H2和1 mol CO2时,则250℃时CO2的平衡转化率可能位于点M2
e.当压强、混合气体的密度或n(H2)/n(CO2)不变时均可视为化学反应已达到平衡状态
(5)保持某温度(大于100℃)不变,在体积为V L的恒容容器中以n(H2)∶n(CO2)=3∶1的投料比加入反应物,至t0时达到化学平衡。t1时将容器体积瞬间扩大至2V L并保持不变,t2时重新达平衡。作出容器内混合气体的平均相对分子质量![]() 随时间变化的图像。
随时间变化的图像。
【答案】(1)-127.8
(2)低温;该反应的ΔH<0,ΔS<0(其他合理答案均可)
(3)0.088(或![]() )
)
(4)a、d
(5)如图,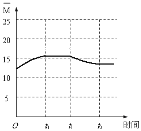 ,起点坐标为(0,12.5),t0达平衡时 应在区间(12.5,20),t2达平衡时 应大于12.5。
,起点坐标为(0,12.5),t0达平衡时 应在区间(12.5,20),t2达平衡时 应大于12.5。
【解析】
试题分析:(1)根据题意(1)①6H2(g)+2CO2(g)![]() CH2=CH2(g)+4H2O(g)△H1
CH2=CH2(g)+4H2O(g)△H1
②H2(g)+![]() O2(g)=H2O(l)△H2=-285.8kJmol-1
O2(g)=H2O(l)△H2=-285.8kJmol-1
③CH2=CH2(g)+3O2(g)=2CO2(g)+2H2O(l)△H3=-1411kJmol-1
④H2O(g) = H2O(l) ΔH=-44 kJ·mol-1
根据盖斯定律:②×6-③-④×4=①,则△H1=6△H2-△H3-4△H=-127.8kJmol-1;故答案为:-127.8;
(2)CO2合成CH2=CH2的反应属于熵减小的反应,根据△G=△S-T△H,反应要自发进行,△G<0,由于△S<0,△H<0,因此低温自发,故答案为:低温;该反应的ΔH<0,ΔS<0;
(3) 6H2(g)+2CO2(g)![]() CH2=CH2(g)+4H2O(g)
CH2=CH2(g)+4H2O(g)
起始(mol)3 1 0 0
反应 1.5 0.5 0.25 1
平衡 1.5 0.5 0.25 1
平衡常数K=![]() =
=![]() =
=![]() ,故答案为:
,故答案为:![]() ;
;
(4)a.该反应放热,温度升高,平衡逆向移动,平衡常数减小,平衡常数大小:M>N,正确;b.温度越高,活化分子百分数越大,活化分子百分数M<N,错误;c.催化剂对化学平衡没有影响,CO2的平衡转化率不变,错误;d.其他条件不变,若投料改为4 mol H2和1 mol CO2时,相当于充入氢气,平衡右移,CO2的平衡转化率增大,正确;e.混合气体的密度始终不变,不能说明化学反应已达到平衡状态,错误。故选a、d;
(5)保持某温度(大于100℃)不变,在体积为V L的恒容容器中以n(H2)∶n(CO2)=3∶1的投料比加入反应物,至t0时达到化学平衡。起始![]() =
=![]() =12.5,随着反应的进行,物质的量减小,
=12.5,随着反应的进行,物质的量减小,![]() 增大,t0达到化学平衡时,
增大,t0达到化学平衡时,![]() =
= ![]() =15.38,t1时将容器体积瞬间扩大至2V L并保持不变,相当于减小压强,平衡逆向移动,气体的物质的量增大,
=15.38,t1时将容器体积瞬间扩大至2V L并保持不变,相当于减小压强,平衡逆向移动,气体的物质的量增大,![]() 减小,但大于12.5,因此图像大致为
减小,但大于12.5,因此图像大致为 ,故答案为:
,故答案为: