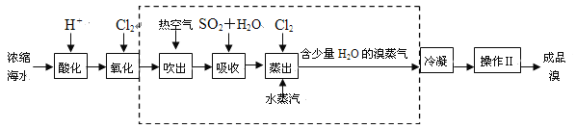
��Ŀ����
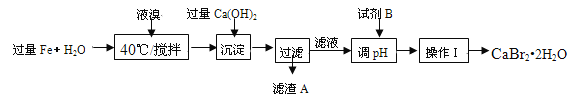
����Ŀ���̷�(FeSO47H2O)������ȱ����ƶѪҩƷ����Ҫ�ɷ�����������������м(����������������������)Ϊԭ�����������̷���һ�ַ�����
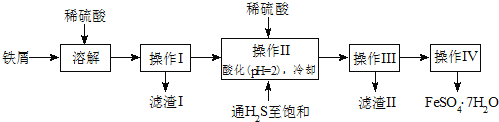
��ѯ���ϣ����й����ʵ��������±���

��1���������У�ͨ�����������͵�Ŀ����______________������Һ���������ữ��pH=2��Ŀ����______________��
��2������������Ҫ�ɷ���______________��
��3������IV�õ����̷�������������ˮϴ�ӣ���Ŀ���ǣ�����ȥ������渽�ŵ���������ʣ���______________��
��4���ⶨ�̷���Ʒ��Fe2+�����ķ����ǣ�a����ȡ2.850g�̷���Ʒ���ܽ⣬��250mL����ƿ�ж��ݣ�b����ȡ25.00mL������Һ����ƿ�У�c���������ữ��0.01000mol/L KMnO4��Һ�ζ����յ㣬����KMnO4��Һ�����ƽ��ֵΪ20.00mL��
���ζ�ʱʢ��KMnO4��Һ������Ϊ______________(����������)��
���жϴ˵ζ�ʵ��ﵽ�յ�ķ�����______________��
������������Ʒ��FeSO47H2O����������Ϊ______________��
���𰸡�
��1����ȥ��Һ�е�Sn2+���ӣ�����ֹFe2+����������ֹFe2+�������ɳ�����
��2�� SnS��
��3������ϴ�ӹ�����FeSO47H2O����ģ�
��4������ʽ�ζ��ܣ�
���μ����һ��KMnO4��Һʱ����Һ���dz��ɫ�Ұ�����ڲ���ɫ��
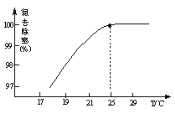
��97.54%
��������
�����������1��ͨ�����������͵�Ŀ���ǣ��������ǿ��ԭ�ԣ����Է�ֹ�������ӱ���������֪����H2S������Һ�У�SnS������ȫʱ��Һ��pHΪ1.6��FeS��ʼ����ʱ��Һ��pHΪ3.0��������ȫʱ��pHΪ5.5������������Һ���������ữ��pH=2��Ŀ���ǣ�����ҺPH=2ʱ��Sn2+��ȫ�������������Ӳ��������ʴ�Ϊ����ȥ��Һ�е�Sn2+���ӣ�����ֹFe2+����������ֹFe2+�������ɳ�����
��2������������Ҫ�ɷ���SnS���ʴ�Ϊ��SnS��
��3����ˮ�¶ȵͣ������ܽ�ȼ�С������ϴȥ����������������ӣ������̷��ܽ��������ʧ���ʴ�Ϊ������ϴ�ӹ�����FeSO47H2O����ģ�
��4�������������Һ����ǿ�������������ܣ������ü�ʽ�ζ��ܣ�����ʽ�ζ��ܣ��ʴ�Ϊ����ʽ�ζ��ܣ�
���ζ�ʵ��ﵽ�յ�ʱ���μ����һ��KMnO4��Һʱ����Һ���dz��ɫ�Ұ�����ڲ���ɫ���ʴ�Ϊ���μ����һ��KMnO4��Һʱ����Һ���dz��ɫ�Ұ�����ڲ���ɫ��
��a����ȡ2.8500g�̷���Ʒ���ܽ⣬��250mL����ƿ�ж��ݣ�b����ȡ25.00mL������Һ����ƿ�У�c���������ữ��0.01000mol/L KMnO4��Һ�ζ����յ㣬����KMnO4��Һ�����ƽ��ֵΪ20.00mL����
5Fe2++MnO4-+8H+�T5Fe3++Mn2++4H2O
5 1
n(Fe2+) 0.01000mol/L��0.0200L
����õ���n(Fe2+)=0.001mol��
��250mL��Һ�к�Fe2+=0.001mol��![]() =0.01mol��
=0.01mol��
FeSO47H2O���ʵ���Ϊ0.01mol������=0.01mol��278g/mol=2.78g��
��������=![]() ��100%=97.54%���ʴ�Ϊ��97.54%
��100%=97.54%���ʴ�Ϊ��97.54%

 ��������ϵ�д�
��������ϵ�д� ���ɶ���ܲ��¿�ֱͨ�߿�ϵ�д�
���ɶ���ܲ��¿�ֱͨ�߿�ϵ�д�