题目内容
【题目】三氧化二砷,俗称砒霜,分子式![]() ,是最古老的毒物之一,某含砷元素(
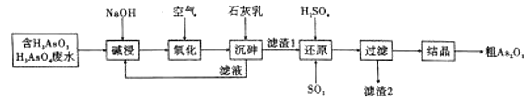
,是最古老的毒物之一,某含砷元素(![]() )的工业废水经如图所示流程转化为粗
)的工业废水经如图所示流程转化为粗![]() 。
。
(1)“碱浸”时发生的反应有:![]() ;
;![]() 。其目的是将废水中的
。其目的是将废水中的![]() 和
和![]() 转化为盐,其中
转化为盐,其中![]() 的化学名称为___________________。
的化学名称为___________________。
(2)“通入空气氧化”时,![]() 转化为
转化为![]() 时反应转移的电子数为______NA。
时反应转移的电子数为______NA。
(3)“沉砷”是将元素转化为![]() 沉淀,发生的主要反应有:
沉淀,发生的主要反应有:
a.![]()
b.![]()
“沉砷”时加人少量稀盐酸,________(填“有利于”或“不利于”)砷元素转化为![]() 沉淀,简述原因:__________________________________。
沉淀,简述原因:__________________________________。
(4)“还原”过程中![]() 转化为
转化为![]() ,反应的化学方程式是_________________________。
,反应的化学方程式是_________________________。
(5)“还原”后过滤所得滤渣2为__________(填化学式),![]() 在低温下微溶于水,加热溶于水后生成
在低温下微溶于水,加热溶于水后生成![]() 溶液,将硫化氢气体通入
溶液,将硫化氢气体通入![]() ,溶液中制备
,溶液中制备![]() 溶胶,写出制取
溶胶,写出制取![]() 溶胶的化学方程式:_____________________________________。已知:
溶胶的化学方程式:_____________________________________。已知:![]() 对其聚沉能力较强,
对其聚沉能力较强,![]() 对其聚沉能力较弱,则
对其聚沉能力较弱,则![]() 胶粒带__________(填“正电荷”或“负电荷”)。
胶粒带__________(填“正电荷”或“负电荷”)。
(6)确定物质中是否含有砒霜,常用马氏试砷法。其原理是在含砒霜的物质中加入![]() 和稀
和稀![]() ,得到一种气体A。加热A,在试管中得到砷镜。写出生成A的离子方程式:____________________。
,得到一种气体A。加热A,在试管中得到砷镜。写出生成A的离子方程式:____________________。
【答案】亚砷酸 4 有利于 加入少量稀盐酸对于a平衡![]() 减小,平衡a正向移动,
减小,平衡a正向移动,![]() 增加,可以使b平衡向正反应方向移动,有利于“沉砷”
增加,可以使b平衡向正反应方向移动,有利于“沉砷” ![]()
![]()
![]() 负电荷
负电荷 ![]()
【解析】
向工业废水(含有H3AsO4、H3AsO3)加入氢氧化钠碱浸:H3AsO4+3NaOH═Na3AsO4+3H2O、H3AsO3+3NaOH═Na3AsO3+3H2O,得到含有Na3AsO4、Na3AsO3的溶液,融入氧气氧化Na3AsO3为Na3AsO4,再加入石灰乳沉砷得到Ca5(AsO4)3OH沉淀,用稀硫酸溶解沉淀,生成H3AsO4和硫酸钙,通入二氧化硫将H3AsO4还原为H3AsO3,反应为:H3AsO4+H2O+SO2═H3AsO3+H2SO4,“还原”后加热溶液,H3AsO3分解为As2O3,调硫酸浓度约为7molL-1,冷却至25℃,过滤,得粗As2O3,据此分析作答。
(1) As元素与N元素同族,![]() 中As元素的化合价为+4价,不是最高价,则
中As元素的化合价为+4价,不是最高价,则![]() 为亚砷酸;
为亚砷酸;
(2) “通入空气氧化”时,![]() 转化为
转化为![]() 时As元素由+4价变为+6价,反应转移的电子数为2mol×2×NA=4 NA;
时As元素由+4价变为+6价,反应转移的电子数为2mol×2×NA=4 NA;
(3)加入少量稀盐酸对于a平衡![]() 减小,
减小,![]() 增加,可以使b平衡向正反应方向移动,有利于“沉砷”;
增加,可以使b平衡向正反应方向移动,有利于“沉砷”;
(4)根据分析,“还原”过程中![]() 和二氧化硫反应转化为
和二氧化硫反应转化为![]() ,反应的化学方程式是H3AsO4+H2O+SO2═H3AsO3+H2SO4;
,反应的化学方程式是H3AsO4+H2O+SO2═H3AsO3+H2SO4;
(5)根据分析,“还原”后过滤所得滤渣2为硫酸钙;![]() 在低温下微溶于水,加热溶于水后生成
在低温下微溶于水,加热溶于水后生成![]() 溶液,将硫化氢气体通入
溶液,将硫化氢气体通入![]() ,溶液中制备
,溶液中制备![]() 溶胶,写出制取
溶胶,写出制取![]() 溶胶的化学方程式:
溶胶的化学方程式:![]() ;
;![]() 和
和![]() 中都含有氯离子,但钙离子比钠离子电荷多,说明
中都含有氯离子,但钙离子比钠离子电荷多,说明![]() 胶粒带负电荷;
胶粒带负电荷;
(6)砒霜的主要成分为氧化砷,向其中加入![]() 和稀
和稀![]() 反应生成硫酸锌和砷化氢,离子方程式为:
反应生成硫酸锌和砷化氢,离子方程式为:![]() 。
。

 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案