题目内容
【题目】25℃时,0.1molL﹣1的HA溶液中c(H+)/c(OH﹣)=1010 . 请回答下列问题:
①HA是 (填“强电解质”或“弱电解质”);
②在加水稀释HA溶液的过程中,随着水量的增加而减小的是 (填字母).
A.c(H+)/c(HA) B.c(HA)/(A﹣) C.c(H+)与c(OH﹣)的乘积 D.c(OH﹣)
③若M溶液是由上述HA溶液V1mL与pH=12的NaOH溶液V2mL混合充分反应而得,则下列说法中正确的是
A.若溶液M呈中性,则溶液M中c(H+)+c(OH﹣)=2.0×10﹣7 molL﹣1
B.若V1=V2 , 则溶液M的pH一定等于7
C.若溶液M呈酸性,V1一定大于V2
D.若溶液M呈碱性,V1一定小于V2 .
【答案】弱电解质;B;AD
【解析】①25℃时,0.1molL﹣1的某酸HA中,如果该酸是强酸,氢离子浓度为0.1mol/L,氢氧根离子浓度为:10﹣13mol/L,则![]() =1012>1010 , 所以该酸是弱酸;所以答案是:弱电解质;
=1012>1010 , 所以该酸是弱酸;所以答案是:弱电解质;
②A.加水稀释促进了弱酸的电离,溶液中氢离子的物质的量增大,HA的物质的量减小,相同溶液中:![]() , 所以其比值增大,故A错误;
, 所以其比值增大,故A错误;
B.加水稀释促进酸电离,酸浓度、酸根离子浓度都降低,但酸根离子浓度减小的量小于酸分子减小的量,所以氢氧根离子浓度增大,则![]() 变小,故B正确;
变小,故B正确;
C.c(H+)与c(OH﹣)的乘积为水的离子积,温度不变,水的离子积常数不变,故C错误;
D.加水稀释促进酸电离,氢离子浓度降低,但氢氧根离子浓度增大,故D错误;
所以答案是:B;
③A.若混合溶液呈中性,则溶液M中c(H+)=c(OH﹣)=1×10﹣7 molL﹣1 , 所以溶液M中c(H+)+c(OH﹣)=2×10﹣7 molL﹣1 , 故A正确;
B.若V1=V2 , 则酸的浓度大,酸过量,则溶液M的pH一定小于7,故B错误;
C.如果溶液呈酸性,则溶液是酸和盐溶液,酸是弱酸,酸浓度大于氢氧化钠浓度,所以V1不一定大于V2 , 故C错误;
D.如果溶液呈碱性,则溶液可能是碱和盐溶液,也可能只是盐溶液,则V1一定小于V2 , 故D正确;
所以答案是:AD.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】已知如表25℃时某些弱酸的电离平衡常数.如图表示常温时,稀释CH3COOH,HClO两种酸的稀溶液时,溶液pH随加水量的变化.依据所给信息,下列说法正确的是( )
CH3COOH | HClO | H2CO3 |
Ka=1.8×10﹣5 | Ka=3.0×10﹣8 | Ka1=4.4×10﹣7 Ka2=4.7×10﹣11 |
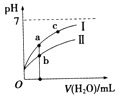
A.如图中的两种酸分别和等浓度的NaOH溶液刚好完全反应,消耗碱的体积相等
B.向NaClO溶液中通入少量二氧化碳的离子方程式为:2ClO﹣+CO2+H2O═2HClO+CO32﹣
C.a、b、c三点所示溶液中水的电离程度c>a>b
D.图象中,Ⅰ表示CH3COOH,Ⅱ表示HClO,且溶液导电性:c>b>a