题目内容
【题目】根据图1给出的装置图回答下列问题: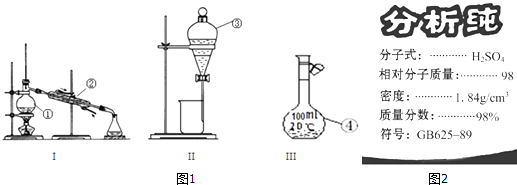
(1)写出下列玻璃仪器的名称:①;② .
(2)①~④中,使用前必须检查是否漏水的是(填仪器序号).分离溴水中的溴应先选择装置(填Ⅰ、Ⅱ或Ⅲ序号)
(3)图2为学校实验室买回的硫酸试剂瓶标签上的部分内容,现欲用此硫酸准确配制浓度为0.18molL﹣1的稀硫酸210mL.
①除量筒、烧杯、玻璃棒、胶头滴管等外,此实验还需要的主要仪器上图有无提供?(填“有”或“无”),如有,在下面横线上填写仪器序号(填①、②、③或④序号),如无,则填写需要怎样的主要仪器: .
②所量取的浓硫酸体积为mL.
③下列操作引起所配溶液浓度偏高的是 .
A.用相同装置配制过0.10mol/L的硫酸溶液后,未清洗即进行此实验的配制
B.移液时未对烧杯和玻璃棒进行洗涤
C.定容时仰视刻度线
D.颠倒摇匀后发现液面低于刻度线,但未加水至刻度线.
【答案】
(1)蒸馏烧瓶,冷凝管
(2)③④,II
(3)无,250ml容量瓶,2.4,A
【解析】解;(1)图中①为蒸馏烧瓶;②为冷凝管;
(2)分液漏斗、容量瓶都能用来盛放液体,且有活塞,使用时必须检查是否漏水;分离溴水中的溴应先加入萃取剂,使溶液分层,然后用分液漏斗进行分液操作分离;
(3)①用浓硫酸配制一定浓度的稀硫酸,步骤为:计算、量取、稀释、移液、洗涤、定容,用到的仪器:量筒、烧杯、玻璃棒、容量瓶、胶头滴管,除量筒、烧杯、玻璃棒、胶头滴管等外,此实验还需要的主要仪器250mL容量瓶,上图中没有;
②浓硫酸物质的量浓度c= ![]() =18.4mol/L,配制浓度为0.18molL﹣1的稀硫酸210mL,应选择250mL容量瓶,设需要浓硫酸体积为V,则依据溶液稀释过程中溶质的物质的量不变得:18.4mol/L×V=0.18mol/L×250mL,解得V=2.4mL;
=18.4mol/L,配制浓度为0.18molL﹣1的稀硫酸210mL,应选择250mL容量瓶,设需要浓硫酸体积为V,则依据溶液稀释过程中溶质的物质的量不变得:18.4mol/L×V=0.18mol/L×250mL,解得V=2.4mL;
③A.用相同装置配制过0.10mol/L的硫酸溶液后,未清洗即,进行此实验的配制,量取的硫酸的物质的量偏大,溶液浓度偏高,故A选;
B.移液时未对烧杯和玻璃棒进行洗涤,导致部分溶质损耗,溶质的物质的量偏小,溶液浓度偏低,故B不选;
C.定容时仰视刻度线,导致溶液体积偏大,溶液浓度偏低,故C不选;
D.颠倒摇匀后发现液面低于刻度线,但未加水至刻度线,属于正常操作,对溶质的物质的量和溶液体积都不会产生影响,溶液浓度准确,故D不选;
故答案为:(1)①蒸馏烧瓶;②冷凝管;(2)3、4,II;(3)①无;250ml容量瓶;②2.4;③A.
(1)根据化学常用仪器的名称确定答案即可。
(2)分液漏斗、容量瓶在使用前均需检漏;从溴水中分离溴应先萃取,再分液;
(3)①配制210mL溶液需要用到250mL容量瓶;
②根据公式![]() 、
、![]() 计算所需浓硫酸体积;
计算所需浓硫酸体积;
③所配溶液浓度偏高,则溶质的物质的量偏大,或最终溶液的体积偏小;据此分析选项。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案


