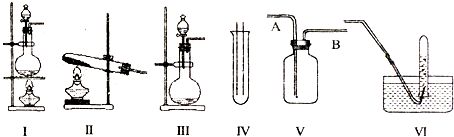
��Ŀ����
����Ŀ����98%��ŨH2SO4����=1.84g/cm3������500ml0.5mol/L��ϡH2SO4 �� �밴Ҫ����գ�
��1������ŨH2SO4�����Ϊ
��2�����ʵ������10mL��20mL��50mL��Ͳ��Ӧѡ��mL��Ͳ��ʵ�����õ������������ձ���������֮�⣬����Ҫ�������У�
��3����ʵ���г������������������ҺŨ����ʲôӰ�죿����ƫ�ߡ�ƫ�͡���Ӱ�죩
��Ũ�����ܽ��δ�������¼�ת�Ƶ�����ƿ
�ڶ���ʱ���ӿ̶���
�����ù����ձ���������δϴ�� ��
���𰸡�
��1��13.6mL
��2��20,��ͷ�ιܡ�500mL����ƿ
��3��ƫ��,ƫ��,ƫ��
���������⣺��1����ŨH2SO4�����ʵ���Ũ��Ϊ��c= ![]() mol/L=18.4mol/L��
mol/L=18.4mol/L��
����ϡ�Ͷ��ɣ�ϡ��ǰ�����ʵ����ʵ������䣬������Ũ������������Ũ��������ΪxL������xL��18.4mol/L=0.5L��0.5mol/L��
��ã�x��0.013.6L=13.6mL������Ӧ��ȡ��Ũ���������13.6mL��
��2�����Ʋ�������ȡ��ϡ�͡���Һ��ϴ�ӡ����ݡ�ҡ�ȵȲ�����һ������Ͳ��ȡ���õ���ͷ�ιܣ����������ձ���ϡ�ͣ���ȴ��ת�Ƶ�500mL����ƿ�У����ò���������������ˮ��Һ�����̶���1��2cmʱ�����ý�ͷ�ιܵμӣ�������Ҫ������Ϊ�����������ձ�����ͷ�ιܡ�20mL��Ͳ��500mL����ƿ����ȱ�ٽ�ͷ�ιܺ�500mL����ƿ��
��3����Ũ�����ܽ��δ�������¼�����ת�ơ����ݣ�һ����ȴ�����ᵼ�����ƫС���������Ƶ���Һ���ƫС�����Ƶ���ҺŨ��ƫ�ߣ�
�ڶ���ʱ���ӿ̶��ߣ��������Ƶ���Һ���ƫС����ҺŨ��ƫ�ߣ�
�����ù����ձ���������δϴ�ӣ����Ƶ���Һ�����ʵ����ʵ���ƫС����ҺŨ��ƫ�ͣ�
�ʴ�Ϊ����1��13.6mL����2��20����ͷ�ιܡ�500mL����ƿ����3����ƫ�ߣ���ƫ�ߣ���ƫ��
��1�����ݹ�ʽ![]() ����Ũ�����Ũ�ȣ����ϡ���������ʵ����ʵ������䣬��������Ũ����������
����Ũ�����Ũ�ȣ����ϡ���������ʵ����ʵ������䣬��������Ũ����������
��2����������õ�Ũ����������ȷ��������Ͳ�����̣�ʵ�����������������ɽ��ʵ�鲽�����ȷ����
��3����Ũ����ϡ���̻�ų�������Һ��������ܵ���������������Ӱ�죻
�ڶ���ʱ���ӿ̶��ߣ�����������Һ�����ƫС��
���ձ���������δϴ�ӣ��ᵼ��������Һ�����ʵ���ƫС��

 ��˼ά������ҵ��ټ��ִ�ѧ������ϵ�д�
��˼ά������ҵ��ټ��ִ�ѧ������ϵ�д� �����������Ż�ѧϰϵ�д�
�����������Ż�ѧϰϵ�д�