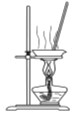
题目内容
【题目】Fe、Ni均为Ⅷ族元素,与C、N、O、P等组成的化合物有广泛的用途。回答下列问题:
(1)基态Ni2+的价层电子轨道表达式为________,C、N、O的第一电离能从小到大的顺序为________。
(2)N、P可形成一些复杂离子,如(CH3)3NH+、NO2+、PCl6-等。
①(CH3)3NH+ 中N原子的杂化类型为___,NO2+的空间构型为______________。
②PCl5是一种白色固体,在加压下于148℃时液化,形成一种能导电的熔体。熔体能导电的原因是___________。
(3)Fe、Ni易与CO形成配合物,Fe(CO)5中σ键与π键个数比为______,Ni(CO)4熔点-25℃,沸点43℃,不溶于水,溶于乙醇、苯等有机溶剂,Ni(CO)4为______晶体。
(4)FeO、NiO的晶体类型与结构和NaCl相同。
① 熔点FeO_____NiO(填“>”、“<”或“=”)。
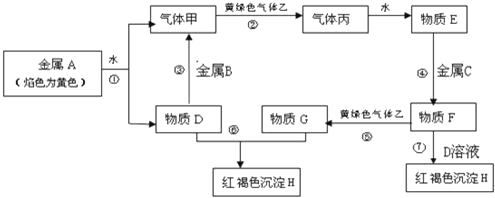
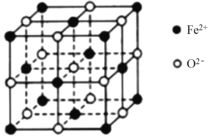
② FeO 晶胞如下图,Fe2+的配位数为_______。
③ FeO在氧气中加热,部分Fe2+被氧化为Fe3+,晶体结构产生铁离子缺位的缺陷,其组成变为FexO(x<1),测得晶胞边长为a cm,密度为g·cm-3,则x=_______。
【答案】![]() C<O<N sp3 直线型 P可形成一些复杂离子如PCl6-,PCl5熔体中含有可自由移动的离子PCl4+和PCl6- 1:1 分子晶体 < 6
C<O<N sp3 直线型 P可形成一些复杂离子如PCl6-,PCl5熔体中含有可自由移动的离子PCl4+和PCl6- 1:1 分子晶体 < 6 ![]()
【解析】
(1)镍为28号元素,据此书写基态Ni2+的价层电子轨道表达式;同一周期,从左到右,元素的第一电离能逐渐增大,但第ⅡA族、第VA族元素的第一电离能大于相邻元素,据此分析判断C、N、O的第一电离能的大小;
(2)①(CH3)3NH+中N原子形成4个σ键,没有孤电子对;NO2+中N原子形成2个σ键,孤电子对数=![]() =0;②根据题干信息,P可形成一些复杂离子如PCl6-,据此分析解答;
=0;②根据题干信息,P可形成一些复杂离子如PCl6-,据此分析解答;
(3)Fe(CO)5中存在5个配位键和5个C≡O,据此计算σ键与π键个数比;根据Ni(CO)4的性质分析判断晶体类型;
(4)① 铁原子半径比镍大,据此判断晶格能FeO与NiO的大小,再判断熔点;②根据FeO 晶胞图,亚铁离子位于顶点和面心,氧离子位于体心和棱的中点,分析判断Fe2+的配位数;
③FeO的晶体结构与氯化钠的晶体结构相同,晶胞中含4个FexO,根据晶胞的密度=![]() 分析解答。
分析解答。
(1)镍为28号元素,基态Ni2+的价层电子轨道表达式为![]() ;同一周期,从左到右,元素的第一电离能逐渐增大,但第ⅡA族、第VA族元素的第一电离能大于相邻元素,C、N、O的第一电离能从小到大的顺序为C<O<N,故答案为:
;同一周期,从左到右,元素的第一电离能逐渐增大,但第ⅡA族、第VA族元素的第一电离能大于相邻元素,C、N、O的第一电离能从小到大的顺序为C<O<N,故答案为:![]() ;C<O<N;
;C<O<N;
(2)①(CH3)3NH+中N原子形成4个σ键,没有孤电子对,杂化类型为sp3,NO2+中N原子形成2个σ键,孤电子对数=![]() =0,杂化类型为sp,空间构型为直线型,故答案为:sp3;直线型;
=0,杂化类型为sp,空间构型为直线型,故答案为:sp3;直线型;
②PCl5是一种白色固体,在加压下于148℃时液化,形成一种能导电的熔体,根据题干信息,P可形成一些复杂离子如PCl6-,因此PCl5熔体中含有可自由移动的离子PCl4+和PCl6-,使得熔体能导电,故答案为: P可形成一些复杂离子如PCl6-,PCl5熔体中含有可自由移动的离子PCl4+和PCl6-;
(3)Fe(CO)5中存在5个配位键和5个C≡O,因此σ键与π键个数比为(5+5):(5×2)=1:1;Ni(CO)4熔点-25℃,沸点43℃,不溶于水,溶于乙醇、苯等有机溶剂,符合分子晶体的性质,因此Ni(CO)4为分子晶体,故答案为:1:1;分子晶体;
(4)① 铁原子半径比镍大,使得FeO中原子间距离大于NiO,晶格能FeO<NiO,熔点FeO<NiO,故答案为:<;
② 根据FeO 晶胞图,亚铁离子位于顶点和面心,氧离子位于体心和棱的中点,Fe2+的配位数为6,故答案为:6;
③FeO的晶体结构与氯化钠的晶体结构相同,晶胞中含4个FexO,则摩尔质量M=(56x+16)g/mol,FexO的晶胞边长为a cm,密度为g·cm-3,则g·cm-3=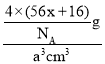 =
=![]() g·cm-3,因此56x+16=
g·cm-3,因此56x+16=![]() ,x=
,x=![]() ,故答案为:
,故答案为:![]() 。
。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】某电路板生产企业的水质情况及国家允许排放的污水标准如下表所示。为研究废水中Cu2+处理的最佳pH,取5份等量的废水,分别用30%的NaOH溶液调节pH至8.5、9、9.5、10、11,静置后,分析上层清液中铜元素的含量,实验结果如下图所示。查阅资料:
平衡Ⅰ:Cu(OH)2+4NH3![]() [Cu(NH3)4]2+2OH-
[Cu(NH3)4]2+2OH-
平衡Ⅱ:Cu(OH)2+2OH-![]() [Cu(OH-)4]2-
[Cu(OH-)4]2-
项目 | 废水水质 | 排放标准 |
pH | 1.0 | 6~9 |
Cu2+/mg·L-1 | 72 | ≤0.5 |
Nh4+/mg·L-1 | 2632 | ≤15 |
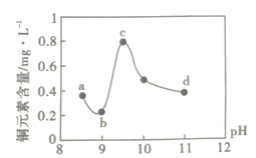
下列说法错误的是( )
A.a~b段发生的反应为:Cu2++2OH-=Cu(OH)2↓
B.b~c段:随pH升高,Cu(OH)2的量增加,导致平衡Ⅰ正向移动,铜元素含量上升
C.c~d段:随pH升高,c(OH-)增加,平衡Ⅰ逆向移动,铜元素含量下降
D.d点以后,随c(OH-)增加,铜元素含量可能上升