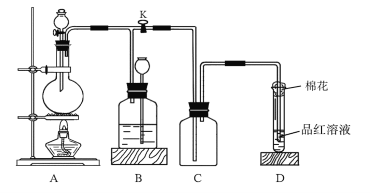
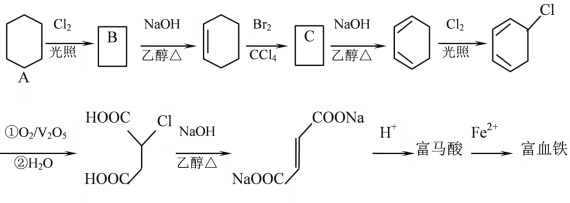
题目内容
【题目】将5.1 g镁铝合金溶于60 mL 5.0mol·L![]() H
H![]() SO
SO![]() 溶液中,完全溶解后再加入a mL10.0 mol·L
溶液中,完全溶解后再加入a mL10.0 mol·L![]() 的NaOH溶液,此时溶液中的Mg
的NaOH溶液,此时溶液中的Mg![]() 、Al
、Al![]() 恰好完全沉淀,再继续滴加5 mL该NaOH溶液,得到的沉淀质量为9.7 g。
恰好完全沉淀,再继续滴加5 mL该NaOH溶液,得到的沉淀质量为9.7 g。
(1)当加入a=_________mLNaOH溶液时,可使溶液中的Mg![]() 和Al
和Al![]() 恰好完全沉淀。沉淀的最大值为__________ g。
恰好完全沉淀。沉淀的最大值为__________ g。
(2)计算合金溶于硫酸时所产生的氢气在标准状况下的体积___________。(写出计算过程)
【答案】60 13.6 设镁铝合金混合物中含有x molMg,y molAl,则24x+27y=5.1;58x+78y=13.6,解得:x=0.1,y=0.1,可得关系式
![]()
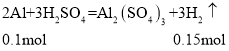
则n(H2)=0.1mol+0.15mol=0.25mol,V(H2)=0.25mol×22.4L/mol=5.6L。
【解析】
(1)所发生的反应为:Mg+H2SO4=MgSO4+H2↑,2Al+3H2SO4=Al2(SO4)3+3H2↑,MgSO4+2NaOH=Mg(OH)2↓+Na2SO4,Al2(SO4)3+6NaOH=2Al(OH)3↓+3Na2SO4,n(H2SO4)=0.06L×5mol/L=0.3mol,当溶液中的Mg![]() 、Al
、Al![]() 恰好完全沉淀时,溶液成分为Na2SO4,此时n(NaOH)=2n(H2SO4)=2×0.3mol=0.6mol,所以
恰好完全沉淀时,溶液成分为Na2SO4,此时n(NaOH)=2n(H2SO4)=2×0.3mol=0.6mol,所以![]() ;Mg
;Mg![]() 、Al
、Al![]() 恰好完全沉淀,再继续滴加5 mL该NaOH溶液,Al(OH)3溶解,得到的沉淀质量为9.7 g,5mL NaOH溶液的物质的量n(NaOH)=0.005L×10mol/L=0.05mol,发生反应:Al(OH)3+NaOH=NaAlO2+2H2O,则溶解的Al(OH)3的物质的量为0.05mol,质量为0.05mol×78g/mol=3.9g,则溶液中的Mg
恰好完全沉淀,再继续滴加5 mL该NaOH溶液,Al(OH)3溶解,得到的沉淀质量为9.7 g,5mL NaOH溶液的物质的量n(NaOH)=0.005L×10mol/L=0.05mol,发生反应:Al(OH)3+NaOH=NaAlO2+2H2O,则溶解的Al(OH)3的物质的量为0.05mol,质量为0.05mol×78g/mol=3.9g,则溶液中的Mg![]() 和Al
和Al![]() 恰好完全沉淀,沉淀的最大值为3.9g+9.7g=13.6g;
恰好完全沉淀,沉淀的最大值为3.9g+9.7g=13.6g;
(2)设镁铝合金混合物中含有x molMg,y molAl,则24x+27y=5.1,58x+78y=13.6,解得:x=0.1,y=0.1,可得关系式
![]()
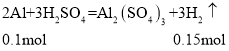
则n(H2)=0.1mol+0.15mol=0.25mol,V(H2)=0.25mol×22.4L/mol=5.6L。

【题目】对下列各项叙述的判断及理由正确的是
选项 | 叙述 | 判断及理由 |
A | 糖类和油脂完全燃烧的产物是CO2和水 | 正确.糖类和油脂的组成元素是C、H、O |
B | 一定条件下乙醇、甲烷均能发生取代反应 | 错误.乙醇不能发生取代反应 |
C | 淀粉和纤维素是同分异构体 | 正确.淀粉和纤维素的化学式均为(C6H10O5)n |
D | 若乙烯中混有SO2气体,可通过酸性高锰酸钾溶液除去 | 正确.酸性条件下SO2可被高锰酸钾氧化 |
A.AB.BC.CD.D
【题目】下列根据实验操作和现象所得出的结论错误的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 向溶液X中先滴加稀硝酸,再滴加Ba(NO3)2溶液 | 出现白色沉淀 | 溶液X不一定含有SO42- |
B | 向FeCl3+3KSCN | 体系颜色无变化 | KCl不能使该平衡移动 |
C | 向浓度均为0.1mol·L-1NaOH和NaI混合溶液中滴加少量AgNO3溶液 | 出现黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
D | 向两份蛋白质溶液中分别滴加饱和NaCl溶液和CuSO4溶液 | 均有固体析出 | 蛋白质均发生变性 |
A.AB.BC.CD.D