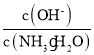题目内容
【题目】某烧碱样品中含有少量不与酸作用的可溶性杂质,为了测定烧碱的纯度,进行以下滴定操作:
A.在250mL容量瓶中定容成250mL烧碱溶液
B.用移液管移取25mL烧碱溶液于锥形瓶中并滴加几滴酚酞指示剂
C.在天平上准确称取烧碱样品W g,在烧杯中加蒸馏水溶解
D.将物质的量浓度为M mol·L-1的标准HCl溶液装入酸式滴定管,调整液面,记下开始刻度数为V1mL
E.在锥形瓶下垫一张白纸,滴定到终点,记录终点酸的体积V2mL
回答下列问题:
(1)正确的操作步骤的顺序是(用字母填写)________→________→________→D→________
(2)使用滴定管之前应进行的操作是________
(3)操作E中的锥形瓶下垫一张白纸的作用是________
(4)若酸式滴定管未用盐酸标准溶液润洗,会对测定结果有何影响________(填“偏高”、“偏低”或“无影响”)
(5)该烧碱样品的纯度计算式________
【答案】C A B E 检漏 便于观察终点时溶液的颜色变化情况 偏高 ![]()
【解析】
实验时应先称量一定质量的固体,溶解后配制成溶液,量取待测液与锥形瓶中,然后用标准液进行滴定,结合滴定操作的注意事项进行解答。
(2)滴定管使用之前应检验是否漏水;
(3)滴定时锥形瓶下垫一张白纸便于观察终点时溶液的颜色变化情况;
(4)根据![]() 分析误差;
分析误差;
(5)根据消耗盐酸的物质的量计算氢氧化钠的质量;样品的纯度=氢氧化钠的质量÷样品质量×100%;
(1)实验时应先称量一定质量的固体,溶解后配制成溶液,量取待测液与锥形瓶中,然后用标准液进行滴定,正确的操作步骤的顺序是C→A→B→D→E;
(2)使用滴定管之前应进行的操作是检漏;
(3)因锥形瓶下垫一张白纸使滴定终点颜色变化更明显,便于准确判断终点时颜色的变化情况;
(4)若酸式滴定管未用盐酸标准溶液润洗,盐酸浓度偏低,消耗盐酸体积偏大,所以测定结果偏高;
(5)滴定过程消耗盐酸的物质的量是(V2mL-V1mL) ×10-3×M mol·L-1,所以25mL烧碱溶液中含氢氧化钠的物质的量是(V2mL-V1mL) ×10-3×M mol·L-1,样品中含氢氧化钠的物质的量是(V2mL-V1mL) ×10-3×M mol·L-1×![]() =(V2mL-V1mL) ×10-2×M mol·L-1,氢氧化钠的质量是(V2mL-V1mL) ×10-2×M mol·L-1×40g/mol=0.4M(V2-V1)g,该烧碱样品的纯度=0.4M(V2-V1)g÷Wg×100%=
=(V2mL-V1mL) ×10-2×M mol·L-1,氢氧化钠的质量是(V2mL-V1mL) ×10-2×M mol·L-1×40g/mol=0.4M(V2-V1)g,该烧碱样品的纯度=0.4M(V2-V1)g÷Wg×100%=![]() 。
。

【题目】在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如表:下列说法错误的是:( )
物质 | X | Y | Z |
初始浓度/ | 0.1 | 0.2 | 0 |
平衡浓度/ | 0.05 | 0.05 | 0.1 |
A.反应达到平衡时,X的转化率为50%
B.反应可表示为X+3Y![]() 2Z,其平衡常数为1600
2Z,其平衡常数为1600
C.改变温度可以改变此反应的平衡常数
D.增压使平衡向生成Z的方向移动,平衡常数增大
【题目】用图所示装置检验乙烯时不需要除杂的是

乙烯的制备 | 试剂X | 试剂Y | |
A | CH3CH2Br与NaOH乙醇溶液共热 | H2O | KMnO4酸性溶液 |
B | CH3CH2Br与NaOH乙醇溶液共热 | H2O | Br2的CCl4溶液 |
C | CH3CH2OH与浓H2SO4共热至170℃ | NaOH溶液 | KMnO4酸性溶液 |
D | CH3CH2OH与浓H2SO4共热至170℃ | NaOH溶液 | Br2的CCl4溶液 |